��Ŀ����
7��ʵ����������ʯ�����Һ����Ҫ��Fe3+������һ������Al3+��Mn2+��Ca2+��Mg2+�ȣ�Ϊԭ���Ʊ��ߴ���������������ͼ1��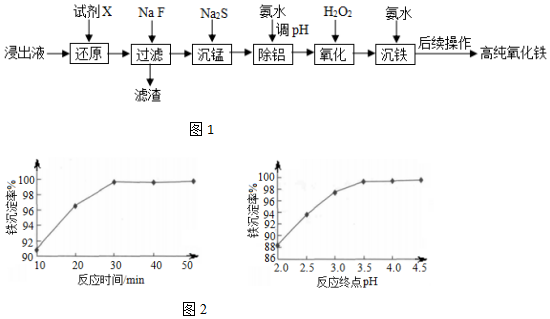
��֪��������ؽ������������������������pH�����
| �������� | Fe3+ | Fe2+ | Al3+ |
| ��ʼ������pH | 1.1 | 5.8 | 3.0 |
| ������ȫ��pH | 3.2 | 8.8 | 5.0 |
A��Zn�� B��NaClO��Һ C��Fe��
��2��������������Ҫ�ɷֳ���������MnF2�⣬������CaF2��MgF2���ѧʽ����
��3�������̡�ʱ����֪��Ksp��MnS��=4.65��10-14��Ϊȷ��������ȫ[����Һ��c��Mn2+����1.0��10-6 mol•L-1]��Ӧ������Һ��c��S2-����4.65��10-8mol•L-1mol•L-1��
��4����������ʱ��������ҺpH�ķ�ΧΪ5.0��5.8��
��5����������ʱ����������K2Cr2O7��Һ����Ƿ����δ�������Ľ������ӣ��÷�Ӧ�����ӷ���ʽΪCr2O72-+14H++6Fe2+�T2Cr3++6Fe3++7H2O��
��6����������ʱ����Ӧ�¶�Ϊ85�������£���Ӧʱ��ͷ�Ӧ�յ�pH�����ij����ʵ�Ӱ��ֱ���ͼ2��ʾ������ѵĹ��������Ƿ�Ӧʱ��30min���յ�pH=3.5��
���� ����ʯ�����Һ����Ҫ��Fe3+������һ������Al3+��Mn2+��Ca2+��Mg2+�ȣ��������ۻ�ԭ������Ϊ�������ӣ�����NaF����Ca2+��Mg2+������ΪCaF2��MgF2������MnF2����ҺΪNa+��Fe2+��Al3+��Mn2+���������Ƴ����̣����ˣ���ҺΪNa+��Fe2+��Al3+�����백ˮ����pHΪ5.0��5.8���������ӣ����ˣ�����Һ�м����������������������Ϊ�����ӣ��ټ��백ˮ����������Ϊ�������������ˡ�ϴ�ӡ�������յõ����������ݴ˷������
��� �⣺��1���Լ�X��ԭ�����ӣ����������ʣ�ѡ������Ϊ�ѣ�
�ʴ�Ϊ��C��
��2������NaF����Ca2+��Mg2+������ΪCaF2��MgF2������MnF2��
�ʴ�Ϊ��CaF2��MgF2��
��3����֪��Ksp��MnS��=4.65��10-14��Ϊȷ��������ȫ[����Һ��c��Mn2+����1.0��10-6 mol•L-1]����c��S2-����$\frac{Ksp��MnS��}{c��Mn{\;}^{2+}��}$=$\frac{4.65��1{0}^{-14}}{1.0��1{0}^{-6}}$=4.65��10-8mol•L-1��
�ʴ�Ϊ��4.65��10-8mol•L-1��
��4�����ݱ��п�֪�������ӳ�����ȫ�����������Ӳ��ܳ�������pH�ķ�ΧӦΪ��5.0��5.8��
�ʴ�Ϊ��5.0��5.8��
��5��������K2Cr2O7��Һ����Ƿ����δ���������������ӣ��������ӱ�����Ϊ�����ӣ����ӷ�ӦΪ��Cr2O72-+14H++6Fe2+�T2Cr3++6Fe3++7H2O��
�ʴ�Ϊ��Cr2O72-+14H++6Fe2+�T2Cr3++6Fe3++7H2O��
��6������ͼ2��֪����Ӧʱ��30min���յ�pH=3.5ʱ�����ij����ʽϸߣ�ʱ��������pH�������ij����ʱ仯����
�ʴ�Ϊ����Ӧʱ��30min���յ�pH=3.5��
���� ���⿼�����ʵ��Ʊ�ʵ�鼰�����ķ�����ᴿ��Ϊ��Ƶ���㣬��������ͼ��ÿһ�������ķ�Ӧ�����������ǽⱾ��ؼ���ע���������Ϣ��𣬲��ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�

��Ӧ�٣�CO2��g��+H2��g��?CO��g��+H2O��g����H1=41kJ•mol-1
��Ӧ�ڣ�CO��g��+2H2��g��?CH3OH��g����H2=-99kJ•mol-1
��Ӧ�ۣ�CO2��g��+3H2��g��?CH3OH��g��+H2O��l����H3��
| A�� | ��Ӧ��Ϊ���ȷ�Ӧ | B�� | ����Ӧ�ٵ�ѹǿ��H2ת������� | ||
| C�� | ��Ӧ��ʹ�ô�������H2���� | D�� | ��H3=-58 KJ•mol-1 |
| A�� | ���³�ѹ�£�0.1NA��NH3���ӵ�����Ϊ1.7g | |
| B�� | ��״���£�1mol����������Ϊ22.4L | |
| C�� | 2.4g����þת��Ϊþ����ʱʧȥ�ĵ�����ĿΪ0.1NA | |
| D�� | 1L 1mol/L NaCl��Һ�к��е���������ΪNA |

| A�� | ͼ�ٿ��Ա�ʾ�ھ��������з���N2��H2���ڴ��ϳɵ��Ĺ����У�N2��ת������ʱ��ı仯���� | |
| B�� | ͼ�ڿ��Ա�ʾ��T����ܱ������У���Ӧ2AgBr��s��?2Ag��s��+Br2��g���ﵽƽ�⣬��ʱ�ٿ�ʼ�����������������������������AgBr��s��ʣ��ʱ������ѹǿ�ı仯���� | |
| C�� | ͼ�ۿ��Ա�ʾ�������pH��̼������Һ�ʹ�������Һ��ˮϡ������pH�ı仯���� | |
| D�� | ͼ�ܿ��Ա�ʾ�Ȼ������廯��������Һ�������Ϻ�����û����Һ�м���ŨAgNO3��Һʱ�����ɳ��������ʵ��������AgNO3��Һ����ı仯���� |
| A�� | CH4 | B�� | H2CO3 | C�� | CH3Cl | D�� | HCl |
| ʵ����� | ʵ������ | ʵ��Ŀ�� | |
| A | �����Һ�еμ������ϡ���� | ������ɫ���� | �������Һ���Ƿ���Ag+ |
| B | ����������CO2��CO���徏��ͨ�������� �������Ʒ�ĩ | ����ɫ��ĩ��� | ��ȥCO2���ᴿCO |
| C | ��Na2S��Һ�еμ�������ˮ | ����dz��ɫ���� | ֤���ȵķǽ����Ա����ǿ |
| D | ��Ag2S��Һ�еμ�NaCl��Һ | ������ɫ���� | �Ƚ�Ag2S��AgCl���ܽ�ȴ�С |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | ��ϵͳ�������� ������Ϊ2��5��6-����-4-�һ����� ������Ϊ2��5��6-����-4-�һ����� | |
| B�� | ��ѹ�£������顢�����顢������ķе��������� | |
| C�� | ����  �������� ��������  ��Ԫ�������ͬ����ѧʽ��ΪC6H12O6������Cm��H2O��n����ˣ�������������� ��Ԫ�������ͬ����ѧʽ��ΪC6H12O6������Cm��H2O��n����ˣ�������������� | |
| D�� | 1.0 mol��  ������뺬5.0 mol NaOH��ˮ��Һ��ȫ��Ӧ ������뺬5.0 mol NaOH��ˮ��Һ��ȫ��Ӧ |
| A�� | 4.6g NO2��g����N2O4��g���Ļ�����к���0.3NA��ԭ�� | |
| B�� | 0.1mol�����������Ҵ�����������Ӧ������0.1NA�������������� | |
| C�� | �����½�5.6gFeͶ������Ũ���ᣬ����ת����Ϊ0.3NA | |
| D�� | Na2O2������H2O������Ӧ��ÿ����2.24L���壨��״����������ת����0.4NA |
