题目内容
12.下列实验现象正确且实验操作能达到实验目的是( )| 实验操作 | 实验现象 | 实验目的 | |
| A | 向待测液中滴加盐酸和稀硝酸 | 产生白色沉淀 | 检验待测液中是否含有Ag+ |
| B | 将含有少量CO2的CO气体緩缓通过足量的 过氧化钠粉末 | 淡黄色粉末变白 | 除去CO2,提纯CO |
| C | 在Na2S溶液中滴加新制氯水 | 产生浅黄色沉淀 | 证明氯的非金属性比硫的强 |
| D | 在Ag2S浊液中滴加NaCl溶液 | 产生白色沉淀 | 比较Ag2S和AgCl的溶解度大小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀不一定为AgCl,可能为硫酸银;
B.CO2与过氧化钠反应生成氧气;
C.Na2S溶液中滴加新制氯水,发生置换反应生成S;
D.Qc(AgCl)>Ksp(AgCl)时,生成AgCl沉淀.
解答 解:A.白色沉淀不一定为AgCl,可能为硫酸银,检验银离子,应先加硝酸无现象,再加氯化钡检验,故A错误;
B.CO2与过氧化钠反应生成氧气,CO中引入新杂质,不能除杂,故B错误;
C.Na2S溶液中滴加新制氯水,发生置换反应生成S,则氯的非金属性比硫的强,故C正确;
D.Qc(AgCl)>Ksp(AgCl)时,生成AgCl沉淀,则不能比较Ag2S和AgCl的溶解度大小,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、离子检验、沉淀生成等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
2.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如表:
下列说法正确的是( )
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,达平衡时CH4 的转化率大于NO2的转化率 |
3.一氧化氮与一氧化碳是汽车尾气里的有害物质,他们能缓慢地起反应生成氮气和二氧化碳.对此反应,下列叙不正确的是( )
| A. | 使用催化剂能加快反应速率 | B. | 降低压强能加快反应速率 | ||
| C. | 增大压强能加快反应速率 | D. | 升高温度能加快反应速率 |
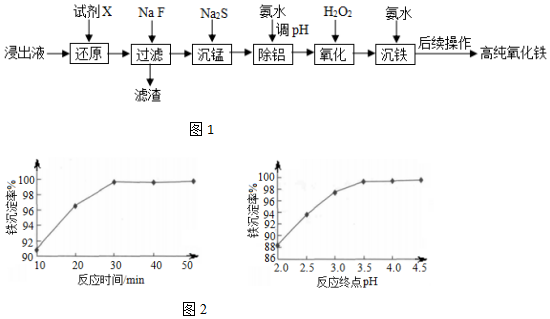
7.实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如图1:
已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
(1)“还原”时,应选择C(填字母).
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有CaF2、MgF2(填化学式).
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10-14.为确保沉锰完全[即溶液中c(Mn2+)<1.0×10-6 mol•L-1],应保持溶液中c(S2-)>4.65×10-8mol•L-1mol•L-1.
(4)“除铝”时,控制溶液pH的范围为5.0~5.8.
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为Cr2O72-+14H++6Fe2+═2Cr3++6Fe3++7H2O.
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是反应时间30min、终点pH=3.5.

已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有CaF2、MgF2(填化学式).
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10-14.为确保沉锰完全[即溶液中c(Mn2+)<1.0×10-6 mol•L-1],应保持溶液中c(S2-)>4.65×10-8mol•L-1mol•L-1.
(4)“除铝”时,控制溶液pH的范围为5.0~5.8.
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为Cr2O72-+14H++6Fe2+═2Cr3++6Fe3++7H2O.
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是反应时间30min、终点pH=3.5.
17.设NA为阿伏加徳罗常数的值.下列叙述不正确的是( )
| A. | 标准状况下,22.4 LHF中所含共价键数目为NA | |
| B. | 已知某FeCl3溶液中Fe3+的物质的量为1 mol,则Cl-的数目大于3NA | |
| C. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目为NA | |
| D. | 在一定条件下,0.2mol NH3充分分解,生成N2的物质的量小于0.1mol |
4.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| B. | 2molNO和1molO2在密闭容器中充分反应,反应后容器中的分子数小于2NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| D. | 1molNa与O2完全反应.生成Na2O和Na2O2的混合物,转移电子总数为NA |
1.下列有关叙述正确的是( )
| A. | XX化妆品从纯天然植物中提取,不含任何化学物质 | |
| B. | 红宝石、玛瑙、水晶、钻石等制作装饰品的材枓,其物质的主要成份都是硅酸盐 | |
| C. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材科 |
15.下列关于有机化合物的叙述正确的是( )
| A. | 糖类、油脂、蛋白质都是天然高分子化合物,一定条件下都能水解 | |
| B. | 甲苯(C7H8)和甘油(C3H8O3)混合物,当总质量一定时,随$\frac{n(C{{\;}_{7}H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,完全燃烧耗氧量和生成水的量都增大 | |
| C. | 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种 | |
| D. | 某烃的结构简式可表示为  (碳原子数≤12),已知烃分子中有两种化学环境不同的氢原子,且数目之比为3:2,则该烃一定是苯的同系物 (碳原子数≤12),已知烃分子中有两种化学环境不同的氢原子,且数目之比为3:2,则该烃一定是苯的同系物 |
 ,H2O2的电子式为
,H2O2的电子式为 ,过二硫酸中氧元素的化合价为-1、-2价.
,过二硫酸中氧元素的化合价为-1、-2价.