��Ŀ����
14��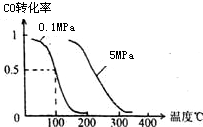 ��1����һ�������£��ݻ�Ϊ 10L�ܱ������з�����Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g������H��0
��1����һ�������£��ݻ�Ϊ 10L�ܱ������з�����Ӧ��CH4��g��+H2O��g��?CO��g��+3H2��g������H��0��1.0mol CH4��2.0mol H2O��g��ͨ����ܱ�����10minʱ��0.1mol CO���ɣ���10min�ڸ÷�Ӧ��ƽ�����ʦԣ�H2��0.003mol/��L��min����
��2����ѹǿΪ0.1MPa�����£��ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״���CO��g��+2H2��g��?CH3OH��g�� ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
�ٸ÷�Ӧ�ġ�H��0 �����������������=������
��100��ʱ�÷�Ӧ��ƽ�ⳣ��K=$\frac{{V}^{2}}{{a}^{2}}$���ú�a��V�Ĵ���ʽ��ʾ����
�����¶��ݻ����������£�����ܱ����������� 2a mol H2���ﵽ��ƽ��ʱ��CO��ת�����������������С�����䡱����ƽ�ⳣ�����䣨���������С�����䡱��
����ij�¶��£���һ���ݻ�������ܱ�������ͨ��2.5mol CO��7.5mol H2��Ӧ����CH3OH��g�����ﵽƽ��ʱCO��ת����Ϊ80%����ʱ�����ڵ�ѹǿΪ��ʼʱ��0.6����
���� ��1������v=$\frac{��c}{��t}$����v��CO�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��H2����
��2������ͼ���֪��ѹǿһ��ʱ�����¶�����CO��ת���ʼ�С��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ��
��A��CO��ת����Ϊ0.5����ת����COΪ0.5a mol����
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol����a 2a 0
�仯����mol����0.5a a 0.5a
ƽ������mol����0.5a a 0.5a
�ٸ���ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$���㣻
�����¶��ݻ����������£�����ܱ����������� 2a mol H2��ƽ�������ƶ���COת��������ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣻
�ܸ���ƽ��ʱCO��ת����Ϊ80%������μӷ�ӦCO�����ʵ��������ò����������������ʵ�����С����������ƽ��ʱ������������ʵ��������º����£�ѹǿ֮�ȵ��������ʵ���֮�ȣ�
��� �⣺��1��v��CO��=$\frac{\frac{0.1mol}{10L}}{10min}$=0.001mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��H2��=3v��CO��=0.003mol/��L��min����
�ʴ�Ϊ��0.003mol/��L��min����
��2������ͼ���֪��ѹǿһ��ʱ�����¶�����CO��ת���ʼ�С��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ���÷�Ӧ�ġ�H��0��
�ʴ�Ϊ������
��A��CO��ת����Ϊ0.5����ת����COΪ0.5a mol����
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol����a 2a 0
�仯����mol����0.5a a 0.5a
ƽ������mol����0.5a a 0.5a
ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$\frac{\frac{0.5a}{V}}{\frac{0.5a}{V}����\frac{a}{V}��^{2}}$=$\frac{{V}^{2}}{{a}^{2}}$��
�ʴ�Ϊ��$\frac{{V}^{2}}{{a}^{2}}$��
�����¶��ݻ����������£�����ܱ����������� 2a mol H2��ƽ�������ƶ���COת��������ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ�������䣻
��ƽ��ʱCO��ת����Ϊ80%���μӷ�ӦCO�����ʵ���Ϊ2.5mol��80%=2mol��
CO��g��+2H2��g��?CH3OH��g�����ʵ�����С
1 2
2mol 4mol
��ƽ��ʱ������������ʵ���Ϊ2.5mol+7.5mol-4mol=6mol�����º����£�ѹǿ֮�ȵ��������ʵ���֮�ȣ��ʴ�ʱ�����ڵ�ѹǿΪ��ʼʱ��$\frac{6mol}{2.5mol+7.5mol}$=0.6����
�ʴ�Ϊ��0.6��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧƽ��ͼ��Ӧ���ʼ���ȣ��ϺõĿ���ѧ������������֪ʶ�������ȡ��Ϣ����������Ŀ�Ѷ��еȣ�

| A�� | ���뵪�� | B�� | ��Сѹǿ������������� | ||
| C�� | ������� | D�� | �ʵ������¶� |
| A�� | Na2CO3 | B�� | NaHCO3 | C�� | Na2CO3 ��NaHCO3 | D�� | NaOH��Na2CO3 |
 I2��KI��Һ�д���ƽ�⣺I2��aq��+I-��aq���TI3- ��aq����ijI2��KI�����Һ�У�c��I3-�����¶�T��ƽ������ͼ���£�����˵������ȷ���ǣ�������
I2��KI��Һ�д���ƽ�⣺I2��aq��+I-��aq���TI3- ��aq����ijI2��KI�����Һ�У�c��I3-�����¶�T��ƽ������ͼ���£�����˵������ȷ���ǣ�������| A�� | ��ӦI2��aq��+I-��aq���TI3- ��aq���ġ�H��0 | |
| B�� | ���¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2 | |
| C�� | ����Ӧ���е�״̬Dʱ��һ����v����v�� | |
| D�� | ״̬A��״̬B��ȣ�״̬A��c��I2�� С |
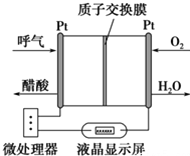 ��ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ����������������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⣮����˵������ȷ���ǣ�������
��ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ����������������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⣮����˵������ȷ���ǣ�������| A�� | �õ�صĸ�����ӦʽΪ��CH3CH2OH+3H2O-12e-�T2CO2��+12H+ | |
| B�� | �õ�ص�������ӦʽΪ��O2+4e-+4H+�T2H2O | |
| C�� | ������O2���ڵIJ��缫�����·������һ�缫 | |
| D�� | ������ͨ����������С����������������оƾ��ĺ��� |
| A�� | �����к���̼������ʴ�����ȴ����� | |
| B�� | �������ӵ��������������Ӵ������� | |
| C�� | ˮ��ĸ�բ������Դ�������ױ���ʴ | |
| D�� | �ִ�������Ƕп�飬���岻�ױ���ʴ |
| A�� | ԭ��������D��C��B��A | B�� | �⻯����ȶ��ԣ�H2C��HD | ||
| C�� | ���Ӱ뾶��C2-��D-��B+��A2+ | D�� | �����ԣ�A2+��B+����ԭ�ԣ�C2-��D- |
| A�� | ����;�����մﵽƽ��ʱ����ϵ�ڻ�������Ũ����ͬ | |
| B�� | ����;�����մﵽƽ��ʱ����ϵ�ڻ������İٷ������ͬ | |
| C�� | �ﵽƽ��ʱ����;���ķ�Ӧ���ʦ�1���ڢ�;���ķ�Ӧ���ʦ�2 | |
| D�� | �ﵽƽ��ʱ����;�����������ܶȵ��ڢ�;�����������ܶ� |
| A�� | +2 | B�� | +3 | C�� | +4 | D�� | +6 |