题目内容
13.下列溶液中,跟150mL0.5mol/LNaCl溶液所含的氯离子物质的量浓度相同的是( )| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
分析 150mL0.5mol/LNaCl溶液中氯离子浓度为0.5mol/L,离子的物质的量浓度=溶质的物质的量浓度×溶质中含有离子的个数,与溶液的体积无关,据此进行计算.
解答 解:150mL 0.5mol/L NaCl溶液溶液中氯离子浓度为0.5mol/L,
A.150mL 0.5 mol/L MgCl2溶液中氯离子浓度为:0.5mol/L×2=1mol/L,故A错误;
B.100mL 1.0mol/L HCl溶液中氯离子浓度为:1.0mol/L×1=1.0mol/L,故B错误;
C.250mL 1.5mol/L NaCl溶液中氯离子浓度为:1.5mol/L×1=1.5mol/L,故C错误;
D.300mL 0.25mol/L CaCl2溶液中氯离子浓度为:0.25mol/L×2=0.5mol/L,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的构成是解答本题的关键,并注意注意离子的浓度与溶液的体积无关,与物质的构成有关.

练习册系列答案
相关题目
3.已知在等温、等容条件下,有如下可逆反应:2A(g)+2B(g)?3C(g)+D(g).现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L.下列叙述正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| C. | 达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2 | |
| D. | 达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度 |
4.一定条件下反应:R2O7n-+3S2-+14H+═2R3++3S+7H2O.则R2O7n-中R的化合价是( )
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
7.下列叙述中,正确的是( )
| A. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NO3-、CO32-、Cl-一定能够大量共存 | |
| C. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 1 L0.1 mol•L-1FeCl3溶液和足量的Zn充分反应,生成11.2 g Fe |
4.下列改变一定能说明化学平衡发生移动的是( )
| A. | 反应混合物中各物质的浓度的改变 | B. | 反应物转化率的改变 | ||
| C. | 正逆反应速率的改变 | D. | 反应容器中压强的改变 |
 A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.
A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.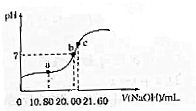 草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.
草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.