题目内容
13.下列有关实验原理、方法或结论的描述正确的是( )| A. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| B. | 向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
分析 A.加入盐酸引入氯离子;
B.温度改变,水的离子积变化;
C.Na2CO3为强碱弱酸盐,水解呈碱性;
D.向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,CCl4萃取溶液中的I2.
解答 解:A.加入盐酸引入氯离子,引入了新的杂质,故A错误;
B.水的离子积只受温度的影响,温度改变,水的离子积变化,故B错误;
C.Na2CO3为强碱弱酸盐,水解呈碱性,加入氯化钡生成碳酸钡沉淀,水解程度减小,故C正确;
D.向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,CCl4萃取溶液中的I2,说明I2在CCl4中的溶解度比在水中的大,故D错误.
故选C.
点评 本题考查较为综合,涉及盐类的水解以及平衡移动等问题,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
4.N2+3H2?2NH3合成氨反应中,在下列情况下,不能使反应速率加快的是( )
| A. | 充入氮气 | B. | 减小压强,扩大容器体积 | ||
| C. | 加入催化剂 | D. | 适当升高温度 |
1.M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热59.2g M(NO3)2使其完全分解,在标准状况下收集22.4L的气体,那么M的摩尔质量是( )
| A. | 24g/mol | B. | 74g/mol | C. | 148g/mol | D. | 40g/mol |
8.用下列实验仪器或装置进行相应实验,能达到实验目的是( )
| A. |  实验测定氯水的pH | |
| B. | 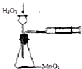 实验定量测定H2O2的分解速率 | |
| C. | 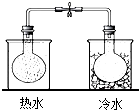 实验中利用NO2颜色的变化验证其中反应的热效应 | |
| D. | 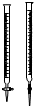 实验中(乙)管内盛放已知浓度的KMnO4溶液来测定FeSO4溶液的浓度 |
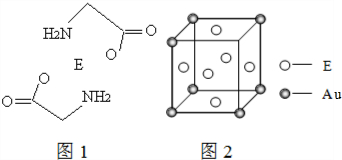
18.A、B、C、D、E是原子序数依次增大的前四周期的常见元素.已知:
(1)写出E原子基态核外电子排布式1s22s22p63s23p63d104s1.比较B、C、D电负性的大小顺序C<N<O.(按由小到大)
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.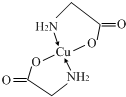 .
.
(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.
 .
.(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.

5.含8.0g NaOH 的溶液中通入一定量CO2后,将得到的溶液低温小心蒸干,称得无水物9.3g,则该无水物中一定含有的物质是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3 和NaHCO3 | D. | NaOH和Na2CO3 |
2. I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)═I3- (aq)的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c(I2) 小 |
3.已知在等温、等容条件下,有如下可逆反应:2A(g)+2B(g)?3C(g)+D(g).现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L.下列叙述正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| C. | 达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2 | |
| D. | 达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度 |

 .
.