题目内容
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A、FeCl3溶液中:Al3+、K+、MnO4-、SO42- |
| B、甲基橙呈黄色的溶液中:K+、Br-、S2-、ClO- |
| C、加入铝粉产生氢气的溶液中:Na+、NH4+、NO3-、Cl- |
| D、Kw/c(OH-)=0.1mol/L的溶液中:Na+、K+、AlO2-、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:A.该组离子之间不反应;
B.甲基橙呈黄色的溶液中显酸性;
C.加入铝粉产生氢气的溶液,为酸或强碱溶液;
D.Kw/c(OH-)=0.1mol/L的溶液中,c(H+)=0.1mol/L,溶液显酸性.
B.甲基橙呈黄色的溶液中显酸性;
C.加入铝粉产生氢气的溶液,为酸或强碱溶液;
D.Kw/c(OH-)=0.1mol/L的溶液中,c(H+)=0.1mol/L,溶液显酸性.
解答:
解:A.该组离子之间不反应,则能大量共存,故A正确;
B.甲基橙呈黄色的溶液中显酸性,S2-、ClO-发生氧化还原反应,则不能共存,故B错误;
C.加入铝粉产生氢气的溶液,为酸或强碱溶液,酸性溶液中Al与NO3-反应不生成氢气,碱溶液中NH4+、OH-反应,则不能共存,故C错误;
D.Kw/c(OH-)=0.1mol/L的溶液中,c(H+)=0.1mol/L,溶液显酸性,氢离子分别与AlO2-、CO32-反应,则不能共存,故D错误;
故选A.
B.甲基橙呈黄色的溶液中显酸性,S2-、ClO-发生氧化还原反应,则不能共存,故B错误;
C.加入铝粉产生氢气的溶液,为酸或强碱溶液,酸性溶液中Al与NO3-反应不生成氢气,碱溶液中NH4+、OH-反应,则不能共存,故C错误;
D.Kw/c(OH-)=0.1mol/L的溶液中,c(H+)=0.1mol/L,溶液显酸性,氢离子分别与AlO2-、CO32-反应,则不能共存,故D错误;
故选A.
点评:本题考查离子的共存问题,明确题目中的信息及隐含信息的挖掘、离子之间的反应即可解答,题目难度不大.

练习册系列答案
相关题目
已知:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,有关该反应的下列说法中正确的是( )
| A、氧化剂和还原剂的物质的量之比为15:11 |
| B、上述反应中转移电子的总数为15 |
| C、1molCuSO4参加反应时,转移电子2mol |
| D、Cu3P既是氧化产物又是还原产物 |
下列离子方程式表达正确的是( )
| A、氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B、双氧水中滴加少量酸性高锰酸钾溶液,溶液紫红色褪去:6H++2MnO4-+5H2O2=2Mn2++5O2↑+8H2O |
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| D、小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
在反应:3BrF3+5H2O═HBrO3+Br2+O2+9HF中(已知BrF3中Br为+3价,F为-1价),当有2mol水参加氧化还原反应时,由水还原的BrF3和总的被还原的BrF3物质的量分别是( )
| A、1mol、3mol |
| B、2mol、3mol |
| C、4/3mol、2mol |
| D、3mol、1mol |
下列化学用语或模型图正确的是( )
| A、1-丁醇的结构简式:C4H10O |
B、四氯化碳的电子式: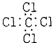 |
C、C2H4的比例模型: |
D、14C的原子结构示意图: |

 (1)常温下,将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,得到密度为1.17g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为
(1)常温下,将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,得到密度为1.17g/cm3的混合溶液,该混合溶液中NaCl的物质的量浓度为 化学-选修物质结构与性质
化学-选修物质结构与性质