题目内容
 化学-选修物质结构与性质
化学-选修物质结构与性质I、元素的电负性和原子半径一样,也是元素的一种基本性质.
| 元素 | Al | B | Be | C | Cl | F | Li | O | S |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 | 3.5 | 2.5 |
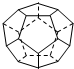
II、德国和美国科学家首先制出由20个碳原子组成的
空心笼状分子C20,该笼状结构是由许多正五边形构成如图.
请回答:C20分子共有
III、Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z.
Q分别与Y、Z形成的共价化合物的化学式是
考点:晶胞的计算,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,极性分子和非极性分子,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:Ⅰ.根据电负性在元素周期表中的递变规律判断;
Ⅱ.利用均摊法分析晶体结构;
Ⅲ.由于Q分别与Y、Z形成共价化合物,则Y、Z可能为非金属元素,又Y、Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z,则Y、Z分别为S、Cl元素;前20号元素中有低价氧化物的Q元素为C元素,Q的低价氧化物CO的电子总数为14,等于X单质分子的电子总数,则X为N元素,以此解答该题.
Ⅱ.利用均摊法分析晶体结构;
Ⅲ.由于Q分别与Y、Z形成共价化合物,则Y、Z可能为非金属元素,又Y、Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z,则Y、Z分别为S、Cl元素;前20号元素中有低价氧化物的Q元素为C元素,Q的低价氧化物CO的电子总数为14,等于X单质分子的电子总数,则X为N元素,以此解答该题.
解答:
解:Ⅰ.同周期元素的原子半径越小,电负性越大,则N>C,又C=S,则N>S,该共用电子对偏向于N,
故答案为:N;
II.解法一:从分子结构示意图可以看出,在C20分子内每个碳原子与另外3个碳原子成键,因此,C20分子键总数=20×3×
(因为2个原子形成一个键),也即C20分子中共有30条棱边(因为化学键总数=多面体棱边总数).从数学角度,多面体棱边数=多面体面数×每个面的棱边数×
(因为2个面共用一条棱边),设正五边形的个数为x,则有:30=x×5×
,所以,正五边形的个数为12.
实际上C20与C60都属于碳的同素异形体,应属于分子晶体.
解法二:设C20分子中含x个正五边形,通过观察图形可知,每一个顶点为三个正五边形共用,则每个正五边形占有该顶点的
,因此,每个正五边形占有碳原子数为5×
个,这个基本结构单元的碳原子数为x×5×
=20,因此,C20分子中含有正五边形个数x=12;每一条边为两个正五边形共用,每个正五边形只占有这条边的,故C-C键的数目为12×5×
=30个,即C20分子中共有30条棱边.故答案为:12;30;
III.由于Q分别与Y、Z形成共价化合物,则Y、Z可能为非金属元素,又Y、Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z,则Y、Z分别为S、Cl元素;前20号元素中有低价氧化物的Q元素为C元素,Q的低价氧化物CO的电子总数为14,等于X单质分子的电子总数,则X为N元素,
C与S、Cl形成的化合物分别为CS2、CCl4,CS2的结构式为S=C=S,C为sp杂化,CCl4形成4个δ键,C为sp3杂化,为正四面体结构,正负电荷重心重叠,为非极性分子,
故答案为:CS2、CCl4;sp和sp3;非极性.
故答案为:N;
II.解法一:从分子结构示意图可以看出,在C20分子内每个碳原子与另外3个碳原子成键,因此,C20分子键总数=20×3×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
实际上C20与C60都属于碳的同素异形体,应属于分子晶体.
解法二:设C20分子中含x个正五边形,通过观察图形可知,每一个顶点为三个正五边形共用,则每个正五边形占有该顶点的
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 2 |
III.由于Q分别与Y、Z形成共价化合物,则Y、Z可能为非金属元素,又Y、Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z,则Y、Z分别为S、Cl元素;前20号元素中有低价氧化物的Q元素为C元素,Q的低价氧化物CO的电子总数为14,等于X单质分子的电子总数,则X为N元素,
C与S、Cl形成的化合物分别为CS2、CCl4,CS2的结构式为S=C=S,C为sp杂化,CCl4形成4个δ键,C为sp3杂化,为正四面体结构,正负电荷重心重叠,为非极性分子,
故答案为:CS2、CCl4;sp和sp3;非极性.
点评:本题考查较为综合,设计晶胞的计算,电负性的比较以及杂化类型的判断,题目难度较大,该题中易错点为Ⅱ,解答时注意利用均摊法结合数学知识分析晶体的结构.

练习册系列答案
相关题目
下列关于电解质的叙述正确的是( )
| A、溶于水能导电的化合物一定是电解质 |
| B、熔融状态能导电的物质一定是电解质 |
| C、易溶于水的电解质一定是强电解质 |
| D、常温下,0.1mol/LHA溶液的PH=1,则HA是强电解质 |
下列说法正确的是( )
①强电解质一定是离子化合物,弱电解质一定是共价化合物 ②强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 ③水难电离,纯水几乎不导电,所以水是弱电解质 ④属于共价化合物的电解质在熔融状态下不导电.
①强电解质一定是离子化合物,弱电解质一定是共价化合物 ②强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 ③水难电离,纯水几乎不导电,所以水是弱电解质 ④属于共价化合物的电解质在熔融状态下不导电.
| A、①② | B、②③ | C、③④ | D、①④ |
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法不正确的是( )
| A、Fe2O3是反应的还原剂 |
| B、Na2O2既是氧化剂又是还原剂 |
| C、Na2FeO4反应的氧化产物 |
| D、Na2FeO4能消毒杀菌是因其具有强氧化性 |
常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A、FeCl3溶液中:Al3+、K+、MnO4-、SO42- |
| B、甲基橙呈黄色的溶液中:K+、Br-、S2-、ClO- |
| C、加入铝粉产生氢气的溶液中:Na+、NH4+、NO3-、Cl- |
| D、Kw/c(OH-)=0.1mol/L的溶液中:Na+、K+、AlO2-、CO32- |
下列反应的离子方程式正确的是( )
| A、Fe(OH)2溶于足量氯水:Fe(OH)2+2H+=Fe2++2H2O |
B、有机物A与足量NaOH溶液共热: |
| C、碳酸钠固体加入盐酸:Na2CO3+2H+=2Na++2H2O+CO2↑ |
| D、NaAlO2溶液与KHCO3溶液混合:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
以NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1mol金属铁与足量硫粉反应,转移2NA个电子 |
| B、18g D2O中含有的质子数目为10 NA |
| C、1L lmol/L的FeC13溶液中含有铁离子的数目为NA |
| D、标准状况下,22.4LCC14中含有氯原子数目为4NA |
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCl2作为氧化剂得到的电子数为NA |
| B、14g氮气中含有7NA个电子 |
| C、在0℃、101kPa时,22.4L氢气中含有NA个氢原子 |
| D、NA个一氧化碳分子和0.5mol甲烷的质量比为7:4 |