题目内容
常温下,现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)上述溶液中,可发生水解的是 (填序号,下同).
(2)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) .
(3)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号) .
(4)将③和④等体积混合后,混合液中各离子浓度关系正确的是 .
A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1mol/L
C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
(5)取10mL溶液③,加水稀释到1L,则此时溶液中由水电离出的c(H+)= .
(1)上述溶液中,可发生水解的是
(2)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(3)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)
(4)将③和④等体积混合后,混合液中各离子浓度关系正确的是
A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1mol/L
C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
(5)取10mL溶液③,加水稀释到1L,则此时溶液中由水电离出的c(H+)=
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)含有弱离子的盐能发生水解;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(3)一水合氨是弱电解质,电离程度最小,溶液中铵根离子浓度最小,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解;
(4)将③和④等体积混合后,溶液中的溶质为等物质的量浓度的NaCl、NH3.H2O,溶液中存在电荷守恒和物料守恒;
(5)先计算稀释后溶液中氢氧根离子浓度,再根据c(H+)=
计算.
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(3)一水合氨是弱电解质,电离程度最小,溶液中铵根离子浓度最小,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解;
(4)将③和④等体积混合后,溶液中的溶质为等物质的量浓度的NaCl、NH3.H2O,溶液中存在电荷守恒和物料守恒;
(5)先计算稀释后溶液中氢氧根离子浓度,再根据c(H+)=
| Kw |
| c(OH-) |
解答:
解:(1)含有弱离子的盐能发生水解,所以能发生水解的有④⑤⑥,故答案为:④⑤⑥;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,硫酸中氢离子浓度最大,氢氧化钠中氢氧根离子浓度大于醋酸,所以水电离出氢离子浓度大小顺序是④>②>③>①,故答案为:④>②>③>①;
(3)一水合氨是弱电解质,电离程度最小,溶液中铵根离子浓度最小,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,则铵根离子浓度大小顺序是⑥>④>⑤>⑦,故答案为:⑥>④>⑤>⑦;
(4)将③和④等体积混合后,溶液中的溶质为等物质的量浓度的NaCl、NH3.H2O,
A.一水合氨和水都电离出氢氧根离子、只有一水合氨电离出铵根离子,结合物料守恒得,离子浓度大小顺序是c(Na+)=c(Cl-)>c(OH-)>c(NH4+),故A正确;
B.溶液体积增大一倍,浓度降为原来一半,所以c(Na+)=0.05mol/L,故B错误;
C.存在电荷守恒c(Na+)+c(NH4+)+c(H+)=c(Cl-)+c(OH-),故C错误;
D.溶液呈碱性,则c(H+)<c(OH-),故D错误;
故选A;
(5)稀释后溶液中c(OH-)=
=0.001mol/L,c(H+)=
=
mol/L=10-12 mol/L,故答案为:10-12.
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,硫酸中氢离子浓度最大,氢氧化钠中氢氧根离子浓度大于醋酸,所以水电离出氢离子浓度大小顺序是④>②>③>①,故答案为:④>②>③>①;
(3)一水合氨是弱电解质,电离程度最小,溶液中铵根离子浓度最小,氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,则铵根离子浓度大小顺序是⑥>④>⑤>⑦,故答案为:⑥>④>⑤>⑦;
(4)将③和④等体积混合后,溶液中的溶质为等物质的量浓度的NaCl、NH3.H2O,
A.一水合氨和水都电离出氢氧根离子、只有一水合氨电离出铵根离子,结合物料守恒得,离子浓度大小顺序是c(Na+)=c(Cl-)>c(OH-)>c(NH4+),故A正确;
B.溶液体积增大一倍,浓度降为原来一半,所以c(Na+)=0.05mol/L,故B错误;
C.存在电荷守恒c(Na+)+c(NH4+)+c(H+)=c(Cl-)+c(OH-),故C错误;
D.溶液呈碱性,则c(H+)<c(OH-),故D错误;
故选A;
(5)稀释后溶液中c(OH-)=
| 0.1mol/L×0.01L |
| 1L |
| Kw |
| c(OH-) |
| 10-14 |
| 0.01 |
点评:本题考查了离子浓度大小比较,涉及弱电解质的电离及盐类水解,明确物质的性质是解本题关键,再结合守恒思想解答,注意(4)中混合溶液体积是氢氧化钠溶液体积的二倍,为易错点.

练习册系列答案
相关题目
下表是元素周期表的一部分,有关说法正确的是?( )
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A、e的氢化物比d的氢化物稳定 |
| B、a、b、e三种元素的原子半径:e>b>a |
| C、六种元素中,c元素单质的化学性质最活泼 |
| D、c、e、f的最高价氧化物对应的水化物都是酸 |
设NA为阿伏加德罗常数,下列有关叙述正确的是.( )
| A、标准状况下,2.24L C6H14中含有的共用电子对数为1.9NA |
| B、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| C、0.50mol的亚硫酸钠中含有的钠离子数为NA |
| D、常温下,7.1gCl2与足量NaOH溶液作用,转移电子的数目为0.2NA |
下列说法正确的是( )
| A、常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol?L-1 |
| B、温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D、中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |

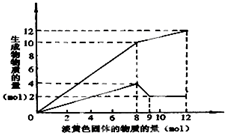 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白: 化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.