题目内容
12.已知:H2(g)+F2(g)═2HF(g)△H=-546.6kJ•mol-1,下列说法中不正确的是( )| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
分析 A、热化学方程式的正逆两个过程的焓变符号相反,数值相等;
B、液态氟化氢的能量比气态氟化氢的能量低,根据反应热与能量关系判断;
C、反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应;
D、根据化学反应的焓变和键能之间的关系来回答.
解答 解:A、由热化学方程式可知44.8L即2mol氟化氢气体分解成22.4L极1mol的氢气和22.4L即1mol的氟气吸收546.6 kJ热量,化学计量数表示物质的量,不是体积,故A错误;
B、液态氟化氢的能量比气态氟化氢的能量低,根据能量守恒,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于546.6 kJ,故B正确;
C、反应为放热反应,在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量,故C正确;
D、旧键的断裂吸收能量,新键的生成释放能量,该反应是放热反应,所以2molH-F键的键能比1molH-H键和1molF-F键的键能之和大546.6kJ,故D正确.
故选A.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系,难度不大,注意反应物总能量大于生成物的总能量为放热反应,反应物总能量小于生成物的总能量为吸热反应.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
3.下列有关物质的性质、应用或制取的说法正确的是( )
| A. | 氯气通入石灰乳中,制取漂白粉 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 实验室保存氯化铁溶液时加少量盐酸,目的是防止Fe3+水解 | |
| D. | 常温下浓硝酸与铝、铁均不反应,可用铝或铁制的容器存放浓硝酸 |
7.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,46gNO2与N2O4的混合气体中含有的原子数为3NA | |
| B. | 15.6g Na2O2与过量CO2反应时,转移的电子数为0.4NA | |
| C. | 常温常压下,11.2L二氧化硫中所含的氧原子数等于NA | |
| D. | 1L1mol•L-1的Na2CO3溶液中含有NA个CO32- |
4.如表为元素周期表的一部分.
请回答下列问题:
(1)Z元素在周期表中的位置为第三周期ⅤⅡA族.
(2)表中元素原子半径最大的非金属是(元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为C3H4.
(5)向氯化铝溶液中加入过量氨水,离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+.
(6)将SO2通入稀硝酸中,反应的离子方程式为3SO2+2H2O+2NO3-═3SO42-+2NO↑+4H+.
| 碳 | 氮 | Y | ||
| 铝 | X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期ⅤⅡA族.
(2)表中元素原子半径最大的非金属是(元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1.Q的化学式为C3H4.
(5)向氯化铝溶液中加入过量氨水,离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+.
(6)将SO2通入稀硝酸中,反应的离子方程式为3SO2+2H2O+2NO3-═3SO42-+2NO↑+4H+.
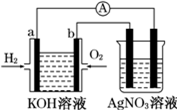 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.