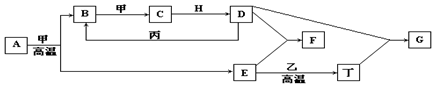
题目内容
10.某同学将0.1mol/L的K2SO4溶液V1L与0.2mol/L的Al2(SO4)3溶液V2 L混合,再加入V3L蒸馏水,假定溶液总体积V总=V1+V2+V3.并测得混合液中三种离子物质的量浓度分别为:K+:0.1mol/L,Al3+:0.1mol/L,SO42-:0.2mol/L,则下列判断正确的是( )| A. | 一定是2L K2SO4溶液和1L Al2(SO4)3溶液混合,再加1L蒸馏水 | |
| B. | 三种液体体积比为V1:V2:V3=2:1:1 | |
| C. | 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值 | |
| D. | 混合液中K2SO4 物质的量等于Al2(SO4)3物质的量的一半 |
分析 c(K+)=$\frac{0.2mol/L×{V}_{1}L}{{V}_{总}}$=$\frac{0.2{V}_{1}}{{V}_{总}}$mol/L ①
(Al3+)=$\frac{0.4mol/L×{V}_{2}L}{{V}_{总}L}$=$\frac{0.4{V}_{2}}{{V}_{总}}$mol/L ②
(SO42-)=$\frac{0.1mol/L×{V}_{1}L+0.6mol/L×{V}_{2}L}{{V}_{总}L}$=$\frac{0.1{V}_{1}+0.6{V}_{2}}{{V}_{总}}$mol/L ③
将$\frac{①}{②}$可求出$\frac{{V}_{1}}{{V}_{2}}$;
从而求出V总,即可求出V1:V2:V3.
据此分析.
解答 解:c(K+)=$\frac{0.2mol/L×{V}_{1}L}{{V}_{总}}$=$\frac{0.2{V}_{1}}{{V}_{总}}$mol/L ①
(Al3+)=$\frac{0.4mol/L×{V}_{2}L}{{V}_{总}L}$=$\frac{0.4{V}_{2}}{{V}_{总}}$mol/L ②
(SO42-)=$\frac{0.1mol/L×{V}_{1}L+0.6mol/L×{V}_{2}L}{{V}_{总}L}$=$\frac{0.1{V}_{1}+0.6{V}_{2}}{{V}_{总}}$mol/L ③
将$\frac{①}{②}$可求出$\frac{{V}_{1}}{{V}_{2}}$=2:1.
设V1=2L,则V2=1L,带入③可得V总=4L,故V3=1L.即三种液体体积比为V1:V2:V3=2:1:1.
A、三种液体体积比为V1:V2:V3=2:1:1,故混合溶液可以是2L K2SO4溶液和1L Al2(SO4)3溶液混合,再加1L蒸馏水,但不一定,故A错误;
B、三种液体体积比为V1:V2:V3=2:1:1,故B正确;
C、由于混合液中三种离子物质的量浓度分别为:K+:0.1mol/L,Al3+:0.1mol/L,SO42-:0.2mol/L,故K+浓度与Al3+浓度数值之和等于SO42-浓度数值,故C错误;
D、混合液中K2SO4 物质的量与Al2(SO4)3的物质的量之比为:$\frac{0.1mol/L×2L}{0.2mol/L×1L}$=1:1,故两者的物质的量相等,故D错误.
故选B.
点评 本题考查了溶液混合后的有关计算,综合性较强,难度适中,注意解题方法的掌握.

| A. | 标准状况下,11.2 L乙醇所含分子数为0.5NA | |
| B. | 40 g氢氧化钠含有氧原子数为NA | |
| C. | 1mol任何纯净物都含有6.02×1023个原子 | |
| D. | 标准状况下,22.4 L氢气含有NA个氢原子 |
| A. | 在0℃、1.01×105Pa的条件下,某气体的体积约为2.24×10-2m3,该气体的物质的量为1 mol | |
| B. | 标准状况下,相同体积的任何气体单质所含的原子数相同 | |
| C. | 在20℃的温度下,1 mol某气体的体积约为22.4 L,该气体的压强为101 kPa | |
| D. | 固态的二氧化碳又叫干冰,含CO21 mol的干冰在标准状况下的体积必定小于22.4 L |