题目内容
2.NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-常温下,pH=5的NaHSO4溶液中水的电离程度= pH=9的NH3•H2O中水的电离程度(填“>”、“=”或“<”)分析 NaHSO4是强电解质,在溶液中能完全电离为钠离子、氢离子和硫酸根离子;pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L;据此分析.
解答 解:NaHSO4是强电解质,在溶液中能完全电离为钠离子、氢离子和硫酸根离子,故电离方程式为NaHSO4=Na++H++SO42-;
pH=5的NaHSO4溶液中,水的电离c(H+)=10-9mol/L,pH=9的NH3•H2O中水的电离c(H+)=10-9mol/L,则两溶液中水的电离程度相等.
故答案为:NaHSO4=Na++H++SO42-;=.
点评 本题考查了电离方程式的书写和酸碱盐的电离程度的影响,题目难度不大,充分考查了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
12.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
10.某同学将0.1mol/L的K2SO4溶液V1L与0.2mol/L的Al2(SO4)3溶液V2 L混合,再加入V3L蒸馏水,假定溶液总体积V总=V1+V2+V3.并测得混合液中三种离子物质的量浓度分别为:K+:0.1mol/L,Al3+:0.1mol/L,SO42-:0.2mol/L,则下列判断正确的是( )
| A. | 一定是2L K2SO4溶液和1L Al2(SO4)3溶液混合,再加1L蒸馏水 | |
| B. | 三种液体体积比为V1:V2:V3=2:1:1 | |
| C. | 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值 | |
| D. | 混合液中K2SO4 物质的量等于Al2(SO4)3物质的量的一半 |
17.现有以下仪器:烧杯、铁架台(带铁夹和铁圈)、酒精灯、玻璃棒、分液漏斗、蒸发皿、蒸馏烧瓶、导管、量筒、500mL容量瓶,根据这些仪器,下列实验可以进行的是( )
| A. | 制取蒸馏水 | B. | 配置500 mL 0.5 mol/L NaCl溶液 | ||
| C. | 除去CaCO3中混有的少量NaCl | D. | 分离食盐水和CCl4的混合液 |
7.人民币一硬币有明亮的银白色的光泽且密度较大,小明同学认为一元硬币中含有铁,他这一想法属于科学探究过程的( )
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
11.与己二酸( )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )
 )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )| A. | 6 种 | B. | 7 种 | C. | 8 种 | D. | 9 种 |
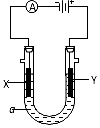 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: