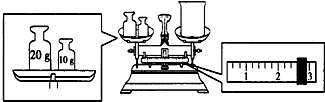
题目内容
18.相同物质的量的O2和O3的质量比为2:3;所含氧原子的个数比为2:3.分析 根据m=nM计算二者质量之比,由N=nNA可知,氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍,据此计算所含氧原子的个数比.
解答 解:根据m=nM可知,相同物质的量的O2和O3的质量之比=32g/mol:48g/mol=2:3,氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍,故相同物质的量的O2和O3含有氧原子数目之比=1×2:1×3=2:3,
故答案为:2:3;2:3.
点评 本题考查物质的量有关计算,比较基础,熟悉计算公式及氧气和臭氧分子结构是解题关键,注意对公式的理解与灵活应用,题目难度不大.

练习册系列答案
相关题目
9.下列说法不正确的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应 | |
| B. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 | |
| C. | 乙醛在一定条件与氢气反应生成乙醇,发生了还原反应 | |
| D. | 鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚 |
6.某无色溶液中可能含有I-、Na+、Fe2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I-;
②肯定不含Fe2+;
③肯定含有SO32-;
④可能含有I-.
①肯定不含I-;
②肯定不含Fe2+;
③肯定含有SO32-;
④可能含有I-.
| A. | ①③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
3.在一定条件下,下列药物的主要成分都能发生四种反应的是( )
①取代反应 ②加成反应③水解反应 ④中和.
①取代反应 ②加成反应③水解反应 ④中和.
| A. | 维生素B5: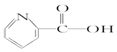 | B. | 阿司匹林: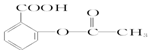 | ||
| C. | 芬必得: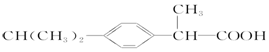 | D. | 摇头丸: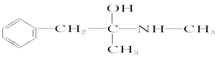 |
10.某同学将0.1mol/L的K2SO4溶液V1L与0.2mol/L的Al2(SO4)3溶液V2 L混合,再加入V3L蒸馏水,假定溶液总体积V总=V1+V2+V3.并测得混合液中三种离子物质的量浓度分别为:K+:0.1mol/L,Al3+:0.1mol/L,SO42-:0.2mol/L,则下列判断正确的是( )
| A. | 一定是2L K2SO4溶液和1L Al2(SO4)3溶液混合,再加1L蒸馏水 | |
| B. | 三种液体体积比为V1:V2:V3=2:1:1 | |
| C. | 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值 | |
| D. | 混合液中K2SO4 物质的量等于Al2(SO4)3物质的量的一半 |
7.人民币一硬币有明亮的银白色的光泽且密度较大,小明同学认为一元硬币中含有铁,他这一想法属于科学探究过程的( )
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
8.在温度t1和t2下(t2>t1),卤素单质X2(g)和H2反应生成HX的平衡常数如下表:
仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,得到的结论是( )
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |