题目内容
19.(1)有溶质的物质的量浓度均为0.2mol•L-1的下列八种溶液①HCl ②H2SO4 ③HClO ④Ba(OH)2 ⑤KOH ⑥NaF ⑦KCl ⑧NH4Cl.这些溶液的pH由小到大的顺序是(填写序号)②①③⑧⑦⑥⑤④.(2)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有有无色无味气体生成、溶液颜色变深或溶液为红褐色或久置有红褐色沉淀.用离子方程式表示产生上述现象的原因Fe3++3H2O?Fe(OH)3+3H+,CaCO3+2H+=Ca2++CO2↑+H2O.
(3)在饱和FeCl3溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是AC(填序号).
A.铁 B.铜 C.镁 D.硫.
分析 (1)酸性溶液的pH<7、中性溶液的pH=7、碱性溶液的pH>7,且酸性越强,溶液的pH越小,碱性越强,溶液的pH越大;先根据溶液酸碱性对各物质进行分类,然后根据电解质的电离,盐的水解程度大小判断溶液中氢离子、氢氧根离子浓度,再判断溶液pH大小;
(2)氯化铁水解呈酸性,可使碳酸钙溶解生成二氧化碳气体,溶液中水解平衡正向进行生成,以此解答;
(3)饱和氯化铁溶液中存在Fe3++3H2O?Fe(OH)3+3H+,若生成气体和红褐色沉淀,平衡正向进行,且加入的物质和酸反应放出氢气.
解答 解:(1)溶质的物质的量浓度均为0.2mol/L的下列八种溶液.
酸性溶液:①HCl为一元强酸;②H2SO4为二元强酸;③HClO为一元弱酸;⑧NH4Cl溶液中,铵根离子水解,溶液显示酸性;溶液的pH:②<①<③<⑧,
碱性溶液:
④Ba(OH)2为二元强碱;⑤KOH为一元强碱;⑥NaF为强碱弱酸盐,溶液显示碱性;
溶液的pH:⑥<⑤<④;
⑦KCl是强酸强碱盐,其溶液呈中性;
通过以上分析知,这几种溶液的pH由小到大的排列顺序是:②①③⑧⑦⑥⑤④,
故答案为:②①③⑧⑦⑥⑤④;
(2)氯化铁水解呈酸性,Fe3++3H2O?Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;
故答案为:①有无色无味气体生成; ②溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O;
(2)在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,平衡正向进行,且加入的物质和酸反应放出氢气,选项中D是非金属单质不能和酸反应,铜是金属不能和稀酸反应,镁和铁与溶液中稀酸反应生成氢气,促进平衡正向进行,生成氢氧化铁红褐色沉淀;
故答案为:AC.
点评 本题考查了盐类的水解应影响水解平衡移动的因素,明确盐类水解规律及化学平衡移动影响因素是解题关键,题目难度不大.

| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应 | |
| B. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 | |
| C. | 乙醛在一定条件与氢气反应生成乙醇,发生了还原反应 | |
| D. | 鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚 |
| A. | 一定是2L K2SO4溶液和1L Al2(SO4)3溶液混合,再加1L蒸馏水 | |
| B. | 三种液体体积比为V1:V2:V3=2:1:1 | |
| C. | 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值 | |
| D. | 混合液中K2SO4 物质的量等于Al2(SO4)3物质的量的一半 |
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
 )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( )| A. | 6 种 | B. | 7 种 | C. | 8 种 | D. | 9 种 |
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
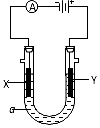 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: