题目内容
14.NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 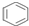 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
分析 A.一水合氨为弱电解质,在溶液中不能部分电离出铵根离子;
B.铁与氯气反应生成氯化铁,1mol铁完全反应失去3mol电子;
C.标况下33.6L二氧化碳的物质的量为1.5mol;
D.苯中碳碳键为一种独特键,不存在碳碳双键.
解答 解:A.一水合氨为弱碱,溶液中一水合氨只能部分电离出铵根离子,无法计算溶液中铵根离子的物质的量,故A错误;
B.1mol铁与足量氯气完全反应生成1mol氯化铁,失去3mol电子,反应转移的电子数为3NA,故B错误;
C.标准状况下,33.6L CO2的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,1.5mol二氧化碳中含有1.5NA个分子,故C正确;
D.苯中碳碳键为一种介于单键和双键之间的独特键,不存在碳碳双键,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项D需要明确苯中碳碳键为一种独特键.

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目
2.下列溶液中离子一定能大量共存的是( )
| A. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| B. | 常温下PH=9的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 0.1mol/LNaOH溶液中:HCO3-、Na+、K+、Ca2+ | |
| D. | 无色溶液中:H+、Cu2+、Al3+、NO3- |
9.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
 则合成该高聚物的单体的正确组合是( )
则合成该高聚物的单体的正确组合是( )