题目内容
9.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
分析 A、液态水变为气态水的过程是吸热过程;
B、固体硫变为气态硫需要吸收热量;
C、碳单质完全燃烧放热多于不完全燃烧放的热.
D、化学反应方程式的系数加倍,焓变数值加倍.
解答 解:A、物质的燃烧反应是放热的,所以焓变是负值,液态水变为气态水的过程是吸热的,故△H1>△H2,故A错误;
B、物质的燃烧反应是放热的,所以焓变是负值,固体硫变为气态硫需要吸收热量,所以△H1>△H2,故B错误;
C、碳单质完全燃烧生成二氧化碳放热多于不完全燃烧生成一氧化碳放的热,反应的焓变是负值,故△H1>△H2,故C错误;
D、化学反应方程式的系数加倍,焓变数值加倍,该化合反应是放热的,所以焓变值是负值,2△H1=△H2,△H1<△H2,故D正确;
故选D.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.33.5g Na2O2吸收CO2后,其质量增加到36.3g,则被吸收的CO2的质量是( )
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
20.飞船以铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化产生高温引发高氯酸铵反应,其方程式为2NH4ClO4═N2↑+Cl2↑+2O2↑+4H2O.下列有关叙述不正确的是( )
| A. | 上述反应属于分解反应、氧化还原反应 | |
| B. | 高氯酸铵属于盐,该反应属于离子反应 | |
| C. | 上述反应瞬间产生的高温气体是推动飞船飞行的主要因素 | |
| D. | 在反应中NH4ClO4既是氧化剂又是还原剂 |
17.(1)工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ•mol-1.
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
根据表中数据计算:
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),下列说法能说明上述反应达到平衡状态的是adf.
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N-H键的同时生成2n mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2h时放出的热量为27.78 kJ.
②0~1h内N2的平均反应速率为0.05 mol•L-1•h-1.
③此温度下该反应的化学平衡常数K=0.15(保留两位小数).
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”或“逆反应”).
4.下列实验能达到预期目的是( )
| A. | 用分液法可分离植物油和水 | |
| B. | 用过滤法可出去食盐中混有的Fe(OH)3胶体 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用盐酸可除去Mg中混有的Al |
14.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 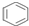 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
16.向等物质的量浓度的MgSO4和NaHSO4的混合溶液中逐滴滴入一定量的Ba(OH)2溶液,下列离子方程式与事实不相符的是( )
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
16.下列有关化学反应的表述不正确的是( )
| A. | NaHS溶液显碱性:HS-+H2O?H3O++S2- | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl | |
| D. | 醋酸使碳酸钙溶解:CaCO3+2CH3COOH═Ca 2++2CH3COO-+CO2↑+H2O |