题目内容
某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺,因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量.”(已知煤炭的燃烧热为-393.15kJ/mol,氢气的燃烧热为-242kJ/mol,一氧化碳的燃烧热为-283kJ/mol)
(1)写出该同学看到燃烧现象所涉及到的所有热化学反应方程式; 、 、 、
(2)你认为该同学的结论是否正确,请简要说明理由. .
(1)写出该同学看到燃烧现象所涉及到的所有热化学反应方程式;
(2)你认为该同学的结论是否正确,请简要说明理由.
考点:热化学方程式
专题:化学反应中的能量变化
分析:依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量;结合反应的热化学方程式书写方法写出,注意标注物质的聚集状态,对应化学方程式量下的反应热;
解答:
解:已知煤炭的燃烧热为-393.15kJ/mol,氢气的燃烧热为-242kJ/mol,一氧化碳的燃烧热为-283kJ/mol;上述反应过程中包括碳燃烧、碳和水的反应,氢气燃烧,一氧化碳燃烧,依据燃烧热概念写出热化学方程式,依据盖斯定律写出碳和水蒸气反应的热化学方程式;
①C (s)+O2(g)=CO2(g)△H=-393.15 kJ/mol;
②H2(g)+
O2 (g)=H2O (l)△H=-285.8kJ/mol
③CO (g)+
O2 (g)=CO2(g)△H=-283 kJ/mol
④依据盖斯定律,①-②-③得到:C (s)+H2O (l)=CO(g)+H2 (g)△H=+175.65 kJ/mol;
故答案为:C (s)+O2 (g)=CO2(g)△H=-393.15 kJ/mol;
H2 (g)+
O2 (g)=H2O (l)△H=-242kJ/mol
CO (g)+
O2 (g)=CO2(g)△H=-283 kJ/mol
C (s)+H2O (l)=CO(g)+H2 (g)△H=+131.85 kJ/mol;
(2)通过分析可知,反应的焓变只与反应物和生成物的能量有关,与反应途径无关,所以煤炭燃烧时加少量水,煤炭燃烧放出的热量多不正确;
故答案为:不正确;因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关;
①C (s)+O2(g)=CO2(g)△H=-393.15 kJ/mol;
②H2(g)+
| 1 |
| 2 |
③CO (g)+
| 1 |
| 2 |
④依据盖斯定律,①-②-③得到:C (s)+H2O (l)=CO(g)+H2 (g)△H=+175.65 kJ/mol;
故答案为:C (s)+O2 (g)=CO2(g)△H=-393.15 kJ/mol;
H2 (g)+
| 1 |
| 2 |
CO (g)+
| 1 |
| 2 |
C (s)+H2O (l)=CO(g)+H2 (g)△H=+131.85 kJ/mol;
(2)通过分析可知,反应的焓变只与反应物和生成物的能量有关,与反应途径无关,所以煤炭燃烧时加少量水,煤炭燃烧放出的热量多不正确;
故答案为:不正确;因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关;
点评:本题考查了物质燃烧热的概念应用,盖斯定律的分析应用,关键是反应焓变与反应途径无关,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
把含有氧化铁的铁投入到足量的稀硫酸中,直到固体全部溶解,经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的氢气的物质的量之比为10:7,则原混合物中单质铁的质量分数为( )
| A、26.3% |
| B、73.7% |
| C、88.2% |
| D、95.1% |
1mol气态烃A最多和2molHCl加成,生成氯代烷B,1mol B与6molCl2发生取代反应,生成只含碳、氯两种元素的化合物.则A的分子式为( )
| A、CH4 |
| B、C3H4 |
| C、C3H6 |
| D、C6H6 |
化学在生产和日常生活中有着重要的应用.下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
部分弱酸的电离平衡常数如表:下列说法正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、0.1 mol?L-lNaHCO3溶液中各离子浓度的大小顺序为:c( Na+)>c(HCO3-)c(HJ-)>c(OH-) |
| B、少量的CO2通人到NaCN溶液中:CN-+H2O+CO2═HCN+HCO3- |
| C、用0.1 mol?L-l NaOH溶液中和等浓度的HCN溶液和HCOOH溶液时,前者所需NaOH溶液体积大 |
| D、相同体积的0.1 mol?L-l HCOONa溶液比0.1 mol?L-l NaCN溶液所含离子总数小 |
下列叙述正确的是( )
| A、在醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的PH<7 |
| C、1.0×10-3盐酸的PH=3,1.0×10-8盐酸的PH=8 |
| D、若1mLPH=1的盐酸与100mLNaOH溶液混合后,溶液的PH=7则NaOH溶液的PH=11 |
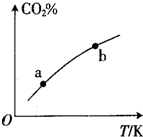 向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )
向某恒容密闭容器中充入一定量C02和H:,发生反应:CO2(g)+H2(g)?HCOOH(g)测得平衡体系中C02的百分含量(CQ%)与反应温度变化的关系如图所示.下列物理量 中,a点大于b点的是 ①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )| A、①② | B、①③ | C、②④ | D、③④ |
下列说法正确的是( )
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C、1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A、88.0g 干冰中含有的电子数为8.0NA |
| B、常温下,11.2 L 乙烯在氧气中完全燃烧转移的电子数为6.0NA |
| C、常温下1.0 L 0.1 mol?L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA |
| D、1.2g 金刚石中含有的碳碳键数为0.4 NA |