题目内容
17.葡萄酒中抗氧化剂的残留量是以游离SO2计算的,我国国家标准规定葡萄酒中SO2残留量≤0.25g•L-1.为测定某葡萄酒中SO2含量设计方案如图1: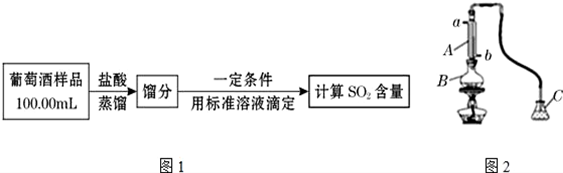
用如图2装置(夹持装置略)蒸馏并收集馏分SO2,实验时B中加入100.00mL葡萄酒样品和适量盐酸,加热使SO2全部逸出,在C中收集馏分.
(1)若C中盛装H2O2溶液,则SO2与其完全反应的化学方程式为:SO2+H2O2=H2SO4,
证明上述反应发生的实验方法是取上述反应液少量于试管中,向其中加入BaCl2溶液,产生了白色沉淀;除去C中过量的H2O2,然后用0.04000mol•L-1NaOH标准溶液进行滴定,滴定前排气泡的方法是将下端尖嘴上翘,挤压玻璃珠.
(2)滴定至终点消耗NaOH溶液25.00mL,据此计算葡萄酒中SO2含量为0.32g•L-l.
(3)由于蒸馏时盐酸易挥发,该测定结果比实际值偏高(填“偏高”、“偏低”或“不变”),因此改进实验方案时可将盐酸改为稀硫酸.
(4)若将图2装置C中盛装的液体改为H2O,且馏分无挥发,改用0.01000mol•L-1标准I2溶液滴定,反应的化学方程式为:SO2+I2+2H2O═H2SO4+2HI,可选择淀粉溶液作指示剂,滴定终点的现象是最后一滴标准液加入时,溶液恰好由无色变为蓝色,半分钟内不褪色.
分析 (1)若C中盛装H2O2溶液,二氧化硫具有还原性,能够与过氧化氢反应生成硫酸,据此写出反应的化学方程式;,证明反应生成可以验证生成的硫酸,加入氯化钡溶液生成白色沉淀设计检验方法,氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;
(2)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(3)由于蒸馏时盐酸易挥发,消耗盐酸增多,该测定结果比实际值高,应改为难挥发性的硫酸;
(4)改用0.01000mol•L-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点.
解答 解:(1)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,证明上述反应发生的实验方法是:取上述反应液少量于试管中,向其中加入BaCl2溶液,产生了白色沉淀,氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:将下端尖嘴上翘,挤压玻璃珠,
故答案为:SO2+H2O2=H2SO4;取上述反应液少量于试管中,向其中加入BaCl2溶液,产生了白色沉淀;将下端尖嘴上翘,挤压玻璃珠;
(2)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:$\frac{0.032g}{0.1L}$=0.32g/L,
故答案为:0.32;
(3)由于蒸馏时盐酸易挥发,测定过程中消耗盐酸量增多,所以该测定结果比实际值高,改进实验方案时可将盐酸改为难挥发的稀硫酸,
故答案为:偏高;稀硫酸;
(4)改用0.01000mol•L-1标准I2溶液滴定,选择淀粉溶液做指示剂,滴定终点的现象是:滴入最后一滴溶液变蓝色半分钟不变化证明反应达到终点,
故答案为:淀粉溶液;最后一滴标准液加入时,溶液恰好由无色变为蓝色,半分钟内不褪色.
点评 本题为考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.

| 选项 | 实验 | 方法或现象 | 结论 |
| A | 检查该装置气密性: | 将注射器针管向右拉动一段距离后松手,能够恢复原位 | 气密性良好 |
| B | 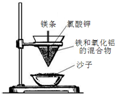 | 点燃镁条后,火花四射,在蒸发皿中产生红热的金属 | 铝热反应: 2Fe+Al2O3$\frac{\underline{\;高温\;}}{\;}$2Al+Fe2O3 |
| C | 将SO2气体通入氢硫酸溶液中 | 有黄色浑浊产生 | 还原性:H2S>SO2 |
| D | 制备CuSO4 | 方法一:用Cu与浓硫酸反应 方法二:用Cu与稀硫酸在不断通入O2的情况下反应 | 方法二更符合绿色化学理念 方法一的原子利用率更高 |
| A. | A | B. | B | C. | C | D. | D |
①生活中使用的漂白粉和肥皂都是混合物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤水玻璃、有色玻璃和果冻都是胶体
⑥汽油属于混合物,而液氯、冰醋酸均属于纯净物
⑦烟、雾、豆浆都是胶体
上述说法正确的是( )
| A. | ①②③⑤⑦ | B. | ③④⑤⑥ | C. | ②④⑤⑦ | D. | ①②④⑥⑦ |
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu、Zn原电池,加快了氢气产生的速率.
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5.
②反应一段时间后,实验E中的金属呈紫红色.
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
| A. | CH4,H2O2,NH3 | B. | H2O,CO2,Na2O2 | C. | Na2O,NaCl,MgCl2 | D. | NaOH,NaClO,Na2O |
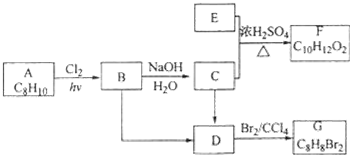
 .
. .
. (填结构简式)
(填结构简式)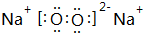 ;Z的化学式为SiO2.
;Z的化学式为SiO2.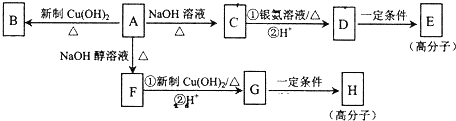
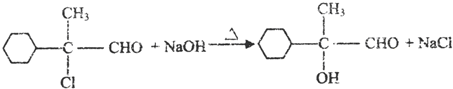 .
. ,E的结构简式是
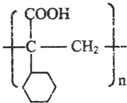
,E的结构简式是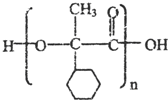 .
.