题目内容
9.下列各组物质,遇到盐酸或强碱溶液都能反应的一组是( )| A. | Cu Al2O3 NaHCO3 | B. | Mg Al(OH)3 Na2CO3 | ||
| C. | Fe Al2O3,Al(OH)3 | D. | Al NaHCO3 Al2O3 |
分析 中学常见既能与盐酸又能与强碱溶液反应的物质有:两性化合物(如Al2O3、Al(OH)3等)、弱酸的铵盐(如(NH4)2CO3等)、弱酸的酸式盐(NaHCO3、NaHS等)、单质(如Al)、氨基酸等.
解答 解:A.Al2O3、NaHCO3能与盐酸、强碱反应,Cu不能与盐酸及强碱反应,故A错误;
B.Al(OH)3 与能与盐酸、强碱反应,Mg不能与强碱反应,故B错误;
C.Al2O3、Al(OH)3能与盐酸、强碱反应,Fe不能与盐酸及强碱反应,故C错误;
D.Al、NaHCO3、Al2O3均能与盐酸、强碱反应,故D正确,
故选:D.
点评 本题考查了元素化合物的性质,掌握物质的性质是解本题的关键,侧重对基础知识的考查,注意归纳总结中学常见的既能与酸反应又能与碱反应的物质.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
19.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子 时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
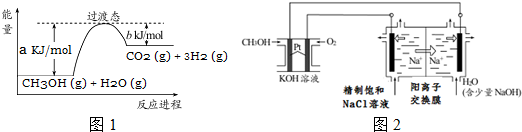
20. 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=:-305.7 kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是吸热反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
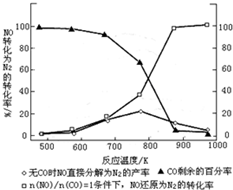
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2→CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=:-305.7 kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2→CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
14.用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是( )
①酸式滴定管用蒸馏水洗后,未用标准液润洗 ②碱式滴定管用蒸馏水洗后,未用待测液润洗 ③配制碱液的称量操作时固体吸潮 ④滴定前酸式滴定管尖嘴部分未充满溶液 ⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外 ⑥滴定前读数正确,达到滴定终点后,俯视读数.
①酸式滴定管用蒸馏水洗后,未用标准液润洗 ②碱式滴定管用蒸馏水洗后,未用待测液润洗 ③配制碱液的称量操作时固体吸潮 ④滴定前酸式滴定管尖嘴部分未充满溶液 ⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外 ⑥滴定前读数正确,达到滴定终点后,俯视读数.
| A. | ①③④ | B. | ②⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤ |
18.下列有关含硅物质的说法正确的是( )
| A. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化碳通入水玻璃可以制得硅酸 | |
| D. | 水泥、玻璃、水晶饰物都是硅酸盐制品 |
19.下列诸因素中,可以解释水的熔、沸点比氯化钠低的是( )
| A. | 水分子中共价键比氯化钠中离子键弱 | |
| B. | 水的相对分子质量比氯化钠的小 | |
| C. | 水分子间有范德华力,氯化钠分子间的作用力较强 | |
| D. | 水分子间是以范德华力相结合,相互作用较弱;氯化钠晶体中,Na+和Cl-以离子键相结合,作用力较强 |