题目内容
3.已知醚类物质不能与Na、K等金属单质发生化学反应.现知二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )| A. | 利用金属钠或者金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
分析 二甲醚和乙醇中分别含有醚键和-OH,二者性质不同,-OH可与Na反应,二者含有的H原子的种类和性质不同,以此解答该题.
解答 解:A.乙醇中含有-OH,可与金属钠或金属钾反应生成氢气,可鉴别,故A正确;
B.利用质谱法,因二者的相对分子质量相等,则不能鉴别,故B错误;
C.二甲醚和乙醇中分别含有醚键和-OH,官能团不同,可用红外光谱法鉴别,故C正确;
D.二者含有的H原子的种类和性质不同,可用核磁共振氢谱鉴别,故D正确.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握物质的性质、性质差异、结构等为解答的关键,侧重分析与应用能力的考查,注意有机物结构的确定方法及应用,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
19.表为元素周期表的一部分
回答下列问题
(1)Y元素在周期表中的位置为第二周期第ⅤIA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实不能说明Z 元素的非金属性比S 元素的非金属性强的是:b
a.Z的单质与H2S溶液反应,溶液变浑浊
b.Z的含氧酸HZO3酸性比H2SO4强
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
d.化合物SZ2中S显正价,Z显负价
(4)表中某元素的最高价含氧酸与其气态氢化物反应生成一种盐,该盐所含化学键的类型为离子键、共价键.
(5)碳、Y和硫三种元素按1:l:l个数比形成化合物,每个原子都达到8电子的稳定结构,该化合物的电子式为 .
.
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成两种有毒气体,均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和lmolO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Y元素在周期表中的位置为第二周期第ⅤIA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实不能说明Z 元素的非金属性比S 元素的非金属性强的是:b
a.Z的单质与H2S溶液反应,溶液变浑浊
b.Z的含氧酸HZO3酸性比H2SO4强
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
d.化合物SZ2中S显正价,Z显负价
(4)表中某元素的最高价含氧酸与其气态氢化物反应生成一种盐,该盐所含化学键的类型为离子键、共价键.
(5)碳、Y和硫三种元素按1:l:l个数比形成化合物,每个原子都达到8电子的稳定结构,该化合物的电子式为
 .
.(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成两种有毒气体,均由表中两种元素组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和lmolO2,则两种气体的分子式及物质的量分别为NO 0.9mol,NO2 1.3mol,生成硫酸铜物质的量为2mol.
14.将磷肥生产中形成的副产物石膏( CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都县有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.

(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式CaSO4+CO32-=CaCO3+SO42-
(3)过滤I操作所得固体中,除CaC03外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-
(5)已知不同温度下K2SO4在l00g水中达到饱和时溶解的量如下表:
60℃时K2S04的饱和溶液591g冷却到0℃,可析出K2S04晶体54g.
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad.
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).

(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式CaSO4+CO32-=CaCO3+SO42-
(3)过滤I操作所得固体中,除CaC03外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-
(5)已知不同温度下K2SO4在l00g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad.
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用(原子利用率高,没有有害物质排放到环境中).
11.某兴趣小组模拟工业处理氨氮废水的原理,进行如下研究
(1)A中反应的化学方程式是Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(2)B中干燥管中应选用的药品为c(填字母)
a.无水 CuSO4 b.硅胶 c.碱石灰
(3)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H=-456kJ•mol-1
已知:

①NH3的电子式是 .
.
②断开1mol H-N键与断开1mol H-Cl键所需能量相差约为40KJkJ.
(4)现象ⅱ中产生白烟的化学方程式是HCl+NH3=NH4Cl
(5)某学生设计了如图装置以完成Cl2和NH3的反应.若该装置能实现设计目标,则
①石墨b电极上发生的是还原反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式:2NH3+6OH--6e-=N2+6H2O.
| 装置 | 操作 | 现象 |
 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |
(2)B中干燥管中应选用的药品为c(填字母)
a.无水 CuSO4 b.硅胶 c.碱石灰
(3)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)═N2(g)+6HCl(g)△H=-456kJ•mol-1
已知:

①NH3的电子式是
 .
.②断开1mol H-N键与断开1mol H-Cl键所需能量相差约为40KJkJ.
(4)现象ⅱ中产生白烟的化学方程式是HCl+NH3=NH4Cl
(5)某学生设计了如图装置以完成Cl2和NH3的反应.若该装置能实现设计目标,则

①石墨b电极上发生的是还原反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式:2NH3+6OH--6e-=N2+6H2O.
18.氟利昂12是甲烷的氯、氟卤代物,结构式为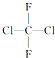 下列有关叙述正确的是( )
下列有关叙述正确的是( )
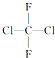 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 它有两种同分异构体 | B. | 它是平面分子 | ||
| C. | 它只有一种结构 | D. | 它有4种同分异构体 |
8.下列实验能获得成功的是( )
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 将苯与浓硝酸和浓硫酸的混合酸共热至50℃~60℃制硝基苯 | |
| C. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| D. | 乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 |
12.下列有机物的命名正确的是( )
| A. |  2-甲基-3-丁烯 2-甲基-3-丁烯 | B. |  1,3,4-三甲苯 1,3,4-三甲苯 | C. |  2-乙基丙烷 2-乙基丙烷 | D. |  2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 |
