题目内容
13.为探索工业含铝、铁、铜合金废料的再利用,化学科技小组的同学们进行了一系列实验探究.他们设计的实验方案如图,其中Y气体是空气的主要成分之一.合金滤液A滤渣B滤渣E沉淀C滤液D溶液G溶液F胆矾绿矾足量烧碱溶液,操作①反应①足量的气体X反应②稀盐酸反应③操作②稀H2SO4,反应④足量气体Y

请回答下列问题:
(1)操作①用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)气体X的分子式为CO2.
(3)反应④的化学反应方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O.
(4)常温下,将绿矾配成约0.1mol•L-1FeSO4溶液,测得溶液的pH=3.请用离子方程式解释原因Fe2++2H2O?Fe(OH)2+2H+,该溶液中c(SO42-)-c(Fe2+)=5×10-4mol•L-1(填数值).
(5)若要测定所配溶液中Fe2+的准确浓度,取20.00mL溶液于锥形瓶中,可再直接用酸性KMnO4标准溶液进行滴定,滴定终点的现象是滴入最后一滴0.02mol•L-1KMnO4酸性溶液,溶液由无色变为浅紫色(或浅紫红色),且30s内不褪色.
分析 铝、铁、铜合金加入足量的烧碱溶液后,金属铝溶解,过滤得滤渣为铁、铜;滤液A中含偏铝酸钠,通入X为二氧化碳气体,得到沉淀C为氢氧化铝,再溶于稀盐酸得到F为氯化铝溶液;滤渣B加入稀硫酸,铁与稀硫酸反应,过滤后得到滤液D为硫酸亚铁溶液,蒸发浓缩、降温结晶得到绿矾,滤渣E主要为铜,铜中加和稀硫酸再通入Y为氧气,得硫酸铜溶液,蒸发浓缩、降温结晶得到胆矾,
(1)操作①为过滤,过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)根据上面的分析可知,X为二氧化碳气体;
(3)反应④为铜与氧气在稀硫酸中,铜被氧化成硫酸铜;
(4)FeSO4溶液中,亚铁离子水解使溶液呈酸性,根据电荷守恒可计算出c(SO42-)-c(Fe2+)的值;
(5)要测定所配溶液中Fe2+的准确浓度,可用酸酸性高锰酸钾溶液滴定,滴定终点时,溶液会出现浅紫色(或浅紫红色),据此答题.
解答 解:合金加入足量的烧碱溶液后,金属铝溶解,过滤得滤渣为铁、铜;滤液A中含偏铝酸钠,通入二氧化碳气体,得到氢氧化铝沉淀;滤渣B加入稀硫酸,铁与稀硫酸反应,得到滤液D为硫酸亚铁溶液,蒸发浓缩、降温结晶得到绿矾,滤渣E主要为铜,铜中加和稀硫酸再加氧化剂Y如双氧水等,得硫酸铜溶液,蒸发浓缩、降温结晶得到胆矾,
(1)操作①为过滤,过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(2)根据上面的分析可知,X为二氧化碳气体,分子式为CO2,
故答案为:CO2;
(3)反应④为铜与氧气在稀硫酸中,铜被氧化成硫酸铜,反应方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:2Cu+2H2SO4+O2=2CuSO4+2H2O;
(4)FeSO4溶液中,亚铁离子水解使溶液呈酸性,反应的离子方程式为Fe2++2H2O?Fe(OH)2+2H+,根据电荷守恒有2c(SO42-)-2c(Fe2+)=c(H+)-c(OH-)=1×10-3,所以(SO42-)-c(Fe2+)=5×10-4,
故答案为:Fe2++2H2O?Fe(OH)2+2H+;5×10-4;
(5)要测定所配溶液中Fe2+的准确浓度,可用酸酸性高锰酸钾溶液滴定,滴定终点的现象是滴入最后一滴0.02 mol•L-1 KMnO4酸性溶液,溶液由无色变为浅紫色(或浅紫红色),且30s内不褪色,
故答案为:滴入最后一滴0.02 mol•L-1 KMnO4酸性溶液,溶液由无色变为浅紫色(或浅紫红色),且30s内不褪色.
点评 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度中.

| A. | 利用金属钠或者金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |

| A. | ①⑤ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
| A. | 标况下,22.4LSO3含有σ键数目为3NA | |
| B. | 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,则某容器内加入0.5 NA个N2(g)与足量的H2(g),充分反应后放出的热量为46 kJ | |
| C. | 标准状况下,22.4L氦气含有的原子数为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
| A. | 将过量SO2通入稀氨水中:SO2+NH3•H2O=HSO3-+NH4+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
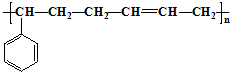 合成这种橡胶的单体应是( )
合成这种橡胶的单体应是( )①苯乙烯 ②苯丙烯 ③2-丁烯 ④丙炔 ⑤1,3-丁二烯.
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 沉淀溶解后,生成的深蓝色配合离子[Cu(NH3)4]2+一定难电离 | |
| C. | 只要含有配位键的化合物就一定是配位化合物 | |
| D. | 在[Cu(NH3)4]2+离子中,既存在离子键,又存在共价键 |
| A. | 水解反应 | B. | 加聚反应 | C. | 加成反应 | D. | 氧化反应 |