题目内容
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,32g三氧化硫的体积约为11.2L | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A、标况下三氧化硫为固体;
B、H218O与D2O的摩尔质量均为20g/mol,均含10个中子;
C、求出二氧化碳的物质的量,然后根据过氧化钠和二氧化碳的反应为歧化反应来分析;
D、二氧化锰只能和浓盐酸反应,和稀盐酸不反应.
解答 解:A、标况下三氧化硫为固体,故32g三氧化硫的体积小于11.2L,故A错误;
B、H218O与D2O的摩尔质量均为20g/mol,均含10个中子,故2.0g混合物的物质的量为0.1mol,故含NA个中子,故B正确;
C、标况下5.6L二氧化碳的物质的量为0.25mol,而过氧化钠和二氧化碳的反应为歧化反应,当1mol过氧化钠反应时,转移1mol电子,消耗1mol二氧化碳,故当0.25mol二氧化碳参与反应后,转移0.25NA个电子,故C错误;
D、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故盐酸不能反应完全,故转移的电子数小于0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列物质中,均不能发生水解反应的一组是( )
| A. | 酶和脂肪 | B. | 油脂和蔗糖 | C. | 淀粉和蛋白质 | D. | 果糖和葡萄糖 |
14.下列有机物命名正确的是( )
| A. | CH3-CH═CH-CH3 二丁烯 | B. | 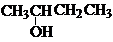 2-羟基丁烷 2-羟基丁烷 | ||
| C. | CH3OOCC2H5 乙酸乙酯 | D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
11.CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:CuCl2溶与乙二胺(H2N-CH2--CH2--NH2),可形成配离子 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )
 ,该配离子不存在的化学键类型类型有( )
,该配离子不存在的化学键类型类型有( )| A. | 配位键 | B. | 极性键 | C. | 离子键 | D. | 非极性键 |
18.下列四种物质:①CO2 ②CHCl3 ③甲烷④CCl4其结构具有正四面体构型的是( )
| A. | ①②③ | B. | ③④ | C. | ②③ | D. | ①②③④ |
16.用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3溶液进行电解,可循环再生 NaOH 同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不.正确的是( ) 

| A. | b 电极上的主要反应是:SO23--2e-+H2O═SO2 4-+2H+ | |
| B. | 若 D 是混合气体,则可能含有 SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有 1 mol Na+通过阳离子交换膜时,a 极生成 11.2 L 气体 | |
| D. | A 溶液是稀 NaOH 溶液,作用是增强溶液的导电性,C 是较浓的硫酸溶液 |