题目内容
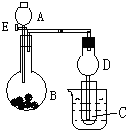
16.用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3溶液进行电解,可循环再生 NaOH 同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不.正确的是( )
| A. | b 电极上的主要反应是:SO23--2e-+H2O═SO2 4-+2H+ | |
| B. | 若 D 是混合气体,则可能含有 SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有 1 mol Na+通过阳离子交换膜时,a 极生成 11.2 L 气体 | |
| D. | A 溶液是稀 NaOH 溶液,作用是增强溶液的导电性,C 是较浓的硫酸溶液 |
分析 依据电解质溶液中阴阳离子的移动方向判断电极,阳离子移向阴极,a为阴极,b为阳极,SO32-在阳极失去电子变成SO42-,可能伴有氢氧根离子放电生成氧气,所以C口流出的物质是H2SO4,阴极区放电离子为氢离子生成氢气,据此解答.
解答 解:A.b极为阳极,亚硫酸根离子在阳极上失去电离生成硫酸根离子,电极反应式为:SO32--2e-+H2O═SO42-+2H+,故A正确;
B.亚硫酸根离子与稀硫酸反应生成二氧化硫,b极伴随副反应氢氧根离子失去电子生成氧气,所以若D是混合气体,则可能含有SO2、O2等成分,故B正确;
C.未指明气体状况,不能确定生成氢气的体积,故C错误;
D.水为弱电解质,导电能力弱,随着反应不断进行,a极溶液中氢氧根离子不断减少,应及时补充稀氢氧化钠,增强溶液导电性,b为阳极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是浓H2SO4,故D正确;
故选:C.
点评 本题考查了电解的原理,明确电解池工作原理是解题关键,注意电解质电极判断的方法和电极反应式书写注意问题为易错点.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,32g三氧化硫的体积约为11.2L | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
7.足量的SO2气体通入下列溶液中,不会变成无色溶液的是( )
| A. | 紫色石蕊溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 品红溶液 |
11.甲苯苯环上有一个 H 原子被-C3H6Cl 取代,形成的同分异构体有(不考虑立体异构)( )
| A. | 9 种 | B. | 12 种 | C. | 15 种 | D. | 18 种 |
1.酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和 NH4Cl 等组成的糊状填充物.该电池放电过程产生 MnOOH.回收处理该废电池可得到多种化工原料.有关数据如表所示溶解度/(g/100g 水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+;.
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶(填操作方法)分离回收;欲从滤渣中得到较纯的 MnO2,最简便的方法为在足量的空气或氧气中加热.
(3)用废电池的锌皮制备 ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀 H2SO4和 H2O2溶解,铁变为Fe3+,加碱调节至 pH 为3时,铁刚好沉淀完全(离子浓度小于 1×10-5 mol•L-1时,即可认为该离子沉淀完全);继续加碱至 pH 为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2后果是Zn2+和Fe2+不能分离.
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-38 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+;.
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有 ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶(填操作方法)分离回收;欲从滤渣中得到较纯的 MnO2,最简便的方法为在足量的空气或氧气中加热.
(3)用废电池的锌皮制备 ZnSO4•7H2O 的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀 H2SO4和 H2O2溶解,铁变为Fe3+,加碱调节至 pH 为3时,铁刚好沉淀完全(离子浓度小于 1×10-5 mol•L-1时,即可认为该离子沉淀完全);继续加碱至 pH 为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2后果是Zn2+和Fe2+不能分离.
8.在标准状况下,0.5mol二氧化碳的体积约是( )
| A. | 0.5L | B. | 22.4L | C. | 11.2L | D. | 44.8L |
6.菲的结构简式如图,若菲分子中有1个H原子被Cl原子取代,则所得一氯取代产物有( )


| A. | 4种 | B. | 14种 | C. | 10种 | D. | 5种 |
 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: