题目内容
7.某学生需要480mL,0.2mol/L的Na2SO4溶液,现用容量瓶配制该溶液,需称取Na2SO4•5H2O的质量为23.2g,若将上述10ml溶液用水稀释到100ml,所得溶液中Na+的物质的量浓度为0.04mol/L,若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1mol/L的BaCl2溶液20mL.分析 需要480mL,0.2mol/L的Na2SO4溶液,现用容量瓶配制该溶液,所以容量瓶为500ml,所以硫酸钠的物质的量为:0.5mol×0.2mol/L=0.1mol,需称取Na2SO4•5H2O的质量为0.1mol×232g/mol=23.2g,根据稀释过程中溶质的物质的量不变计算出稀释后溶液中钠离子的浓度;硫酸根离子与钡离子按照物质的量1:1反应,结合100mL硫酸钠溶液中含有的硫酸根离子的物质的量计算出需要钡离子的物质的量,再计算出需要氯化钡溶液的体积.
解答 解:需要480mL,0.2mol/L的Na2SO4溶液,现用容量瓶配制该溶液,所以容量瓶为500ml,所以硫酸钠的物质的量为:0.5mol×0.2mol/L=0.1mol,需称取Na2SO4•5H2O的质量为0.1mol×232g/mol=23.2g,据稀释定律,稀释过程中钠离子的物质的量不变,则稀释后Na+的物质的量浓度=$\frac{0.2mol/L×2×0.01L}{0.1L}$=0.04mol/L;
稀释后硫酸钠的物质的量不变,10mL溶液中硫酸钠的物质的量为:0.2mol/L×0.01L=0.002mol,
将稀释后溶液中的SO42-全部沉淀下来,则n(BaCl2)=n(Na2SO4)=0.002mol,需要氯化钡溶液的体积为:$\frac{0.002mol}{0.1mol/L}$=0.02L=20mL,
故答案为:23.2g;0.04;20.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意溶液稀释定律的内容及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
17.暴露在空气中质量会变轻的物质是( )
| A. | 氢氧化钠 | B. | 生石灰 | C. | 浓硫酸 | D. | 浓硝酸 |
18.今年5月28日中午,大亚湾惠州兴达石化工业有限公司一个存储有900立方米苯乙烯的储罐发生火灾.消防官兵经过10多个小时扑救,直到苯乙烯烧完才将大火扑灭.苯乙烯的结构式为 ,下列有关苯乙烯的说法不正确的是( )
,下列有关苯乙烯的说法不正确的是( )
 ,下列有关苯乙烯的说法不正确的是( )
,下列有关苯乙烯的说法不正确的是( )| A. | 苯乙烯的分子式为C8H8 | |
| B. | 1个苯乙烯分子完全加成,需要4摩尔H2 | |
| C. | 苯乙烯能使溴水或酸性高锰酸钾溶液褪色 | |
| D. | 苯乙烯与氯气既能发生加成反应,又能发生取代反应 |
2.增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油品质的措施,常用方法有催化重整等.例如以下两个在催化重整时发生的反应:
①CH3(CH2)4CH3$\stackrel{-H_{2}}{→}$ $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$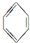
②CH3(CH2)4CH3→
下列叙述正确的是( )
①CH3(CH2)4CH3$\stackrel{-H_{2}}{→}$
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$
②CH3(CH2)4CH3→

下列叙述正确的是( )
| A. | 反应①中间产物和反应②产物互为同分异构体 | |
| B. | 反应①中间产物和最终产物的一氯代物都只有一种 | |
| C. | 反应②产物中的六个碳原子可能在同一平面上 | |
| D. | 反应①②均为消去反应 |
9.下列有机物的命名正确的是( )
| A. | 4,4,3-甲基已烷 | B. | 2-甲基-4乙基戊烷 | ||
| C. | 2,2-二甲基戊烷 | D. | 3-甲基-2-乙基庚烷 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,32g三氧化硫的体积约为11.2L | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
7.足量的SO2气体通入下列溶液中,不会变成无色溶液的是( )
| A. | 紫色石蕊溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 品红溶液 |