题目内容
14.某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象.请帮助该同学整理并完成实验报告.| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
实验①Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
实验④2Al+6HCl=2AlCl3+3H2↑.
(4)实验结论:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
分析 (1)实验目的为同周期元素性质递变规律;
(2)根据物质的性质判断实验现象:镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性;钠和冷水反应生成氢氧化钠和氢气;镁条投入稀盐酸中,剧烈反应,迅速产生大量氢气;铝条投入稀盐酸中,反应不十分剧烈,产生氢气;
(3)镁与热水反应生成氢气、氢氧化镁;铝和盐酸反应生成氯化铝和氢气,据此回答;
(4)根据实验现象结合实验目的得出结论.
解答 解:(1)由题目可知,表中的内容研究的是金属钠镁铝的性质,实验目的为探究同周期金属元素性质递变规律,
故答案为:金属;
(2)将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色;
金属钠较活泼,放入滴有酚酞溶液的冷水中因为生成氢氧化钠而使得溶液显示红色,同时还会产生氢气,现象有:浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;
镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体;
将铝条投入稀盐酸中,反应不十分剧烈,产生无色气体.
故答案为:
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象 | B | A | D | C |
故答案为:Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;2Al+6HCl=2AlCl3+3H2↑;
(4)根据实验现象结合实验目的得出结论:第三周期的金属性:Na>Mg>Al或:第三周期元素随着核电荷数的递增,金属性逐渐减弱,
故答案为:第三周期元素随着核电荷数的递增,金属性逐渐减弱.
点评 本题考查同周期元素性质递变规律,题目难度中等,注意物质的性质以及元素周期律的递变规律,侧重于考查学生的实验探究能力和分析应用基础知识的能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
5.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(假设金属的摩尔质量为M g•mol-1,金属原子半径为r cm,用NA表示阿伏加德罗常数的值)( )

| A. | 金属Mg采用②堆积方式 | |
| B. | ①和③中原子的配位数分别为:8、12 | |
| C. | 对于采用②堆积方式的金属,实验测得W g该金属的体积为V cm3,则阿伏加德罗常数NA的表达式为$\frac{MV}{W•(\frac{4}{\sqrt{3}}r)^{3}}$ | |
| D. | ④中空间利用率的表达式为:$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4}{\sqrt{2}}r)^{3}}$×100% |
2.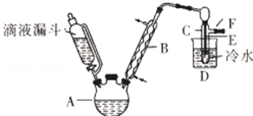 已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
(1)本实验中应采取的加热方式是水浴加热.
(2)为除去产品中的Br2,最好选择下列溶液来洗涤产品B.
A.氢氧化钠 B.亚硫酸钠 C.碘化钠.
 已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)为除去产品中的Br2,最好选择下列溶液来洗涤产品B.
A.氢氧化钠 B.亚硫酸钠 C.碘化钠.
19.化学与生产生活、环境保护、资源利用、能源开发等密切相关.下列说法错误的是( )
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
6.下列物质用途错误的是( )
| A. | 天然气用做燃料 | B. | 无水乙醇直接用作医用消毒 | ||
| C. | 苯酚用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
3. 金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H=+1493kJ•mol-1,△S=+61J•K-1•mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度.目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献.金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g)+C(s)$\stackrel{高温}{?}$TiCl4(g)+CO2(g)△H1,△S1=+64J•K-1•mol-1
反应Ⅱ:TiO2(s)+2Cl2(g)+2C(s)$\stackrel{高温}{?}$TiCl4(g)+2CO(g)△H2,△S2
已知:①C(s)+O2(g)═CO2(g)△H=-394.3kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-222.3kJ•mol-1
请回答:
(1)反应Ⅰ的△H1=+1098.7kJ•mol-1.
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=$\frac{p(C{O}_{2})p(TiC{l}_{4})}{{p}^{2}(C{l}_{2})}$(用表达式表示).
(3)将金红石加碳氯化反应与金红石直接氯化反应比较,从焓变熵变的角度分析金红石加碳氯化能在较温和条件下成功制取TiCl4的原因焓变减小,熵变增大,有利于反应正向进行.
(4)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)═4NH3(g)+3O2(g)△H=+1530.4kJ•mol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见下表:
①请在图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明).
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为4×10-7mol•L-1•h-1.判断组别4中反应是否达到平衡状态否(填“是”或“否”),并说明理由反应正反应为吸热反应,升高温度平衡正向移动,则n(NH3)应大于6.0×10-6mol.
 金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H=+1493kJ•mol-1,△S=+61J•K-1•mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度.目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献.金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g)+C(s)$\stackrel{高温}{?}$TiCl4(g)+CO2(g)△H1,△S1=+64J•K-1•mol-1
反应Ⅱ:TiO2(s)+2Cl2(g)+2C(s)$\stackrel{高温}{?}$TiCl4(g)+2CO(g)△H2,△S2
已知:①C(s)+O2(g)═CO2(g)△H=-394.3kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-222.3kJ•mol-1
请回答:
(1)反应Ⅰ的△H1=+1098.7kJ•mol-1.
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=$\frac{p(C{O}_{2})p(TiC{l}_{4})}{{p}^{2}(C{l}_{2})}$(用表达式表示).
(3)将金红石加碳氯化反应与金红石直接氯化反应比较,从焓变熵变的角度分析金红石加碳氯化能在较温和条件下成功制取TiCl4的原因焓变减小,熵变增大,有利于反应正向进行.
(4)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)═4NH3(g)+3O2(g)△H=+1530.4kJ•mol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见下表:
| 实验组别 | 1 | 2 | 3 | 4 |
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
| 反应时间/h | 3 | 3 | 3 | 3 |
| 容器体积/L | 2 | 2 | 2 | 2 |
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为4×10-7mol•L-1•h-1.判断组别4中反应是否达到平衡状态否(填“是”或“否”),并说明理由反应正反应为吸热反应,升高温度平衡正向移动,则n(NH3)应大于6.0×10-6mol.
4.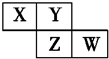 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
 .
.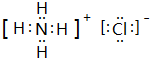 ,A2C2的电子式为
,A2C2的电子式为 .
.