题目内容
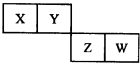 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Z原子最外层电子数是其电子层数的2倍,其最外层电子数为6,故Z为S元素,可推知X为C元素、Y为N元素、W为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.应描述为W的最高价含氧酸的酸性比较Z最高价含氧酸的酸性强;
C.工业上电解饱和氯化钠溶液生成氯气;
D.CO2和CCl4中均含有共价键.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.应描述为W的最高价含氧酸的酸性比较Z最高价含氧酸的酸性强;
C.工业上电解饱和氯化钠溶液生成氯气;
D.CO2和CCl4中均含有共价键.
解答:
解:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Z原子最外层电子数是其电子层数的2倍,其最外层电子数为6,故Z为S元素,可推知X为C元素、Y为N元素、W为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径rZ>rW>rX>rY,故A正确;
B.非金属性Cl>S,不是最高价含氧酸,酸性则不一定,如硫酸为强酸,而次氯酸为弱酸,应描述为W的最高价含氧酸的酸性比较Z最高价含氧酸的酸性强,故B错误;
C.工业上电解饱和氯化钠溶液生成氯气,故C错误;
D.CO2和CCl4中均含有共价键,含有共价键类型相同,故D错误,
故选A.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径rZ>rW>rX>rY,故A正确;
B.非金属性Cl>S,不是最高价含氧酸,酸性则不一定,如硫酸为强酸,而次氯酸为弱酸,应描述为W的最高价含氧酸的酸性比较Z最高价含氧酸的酸性强,故B错误;
C.工业上电解饱和氯化钠溶液生成氯气,故C错误;
D.CO2和CCl4中均含有共价键,含有共价键类型相同,故D错误,
故选A.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,注意对元素周期律的理解掌握,B选项为易错点,学生容易忽略最高价含氧酸.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列说法中错误的是( )
| A、NaHCO3溶液中碳元素主要以HCO3-存在 |
| B、Na2CO3溶液中滴加酚酞呈红色,加热红色变深 |
| C、NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱 |
| D、在稀醋酸中加醋酸钠固体能促进醋酸的电离 |
下列物质中,属于纯净物的是( )
| A、碱石灰 | B、汽油 |
| C、小苏打 | D、铝热剂 |
下列说法错误的是( )
| A、1mol任何粒子的数目都约为6.02×1023 |
| B、0.012kg 12C约含6.02×1023个碳原子 |
| C、使用物质的量时,应用化学式指明粒子的种类 |
| D、O2的摩尔质量等于它的相对分子质量 |