题目内容
将钠在空气中加热一段时间,将之投入水中,收集产生的气体于密闭容器中引燃,恰好完全反应.向所得的溶液中加入100克质量分数为36.5%的盐酸溶液,恰好呈中性.
(1)原来钠的质量为多少?
(2)求加热后产物中剩余的钠与生成的过氧化钠的质量比.
(1)原来钠的质量为多少?
(2)求加热后产物中剩余的钠与生成的过氧化钠的质量比.
考点:化学方程式的有关计算
专题:计算题
分析:(1)在空气中加热的Na投入水中得到NaOH溶液,再加入100克质量分数为36.5%的盐酸溶液,恰好呈中性,则n(NaOH)=n(HCl),再根据Na元素守恒计算Na的质量;
(2)Na在空气中加热一段时间,将之投入水中,收集产生的气体于密闭容器中引燃,恰好完全反应,说明反应生成氢气与氧气,且二者物质的量之比为2:1,令氢气为2mol、氧气为1mol,根据方程式计算Na、过氧化钠的物质的量,再根据m=nM计算剩余的钠与生成的过氧化钠的质量比.
(2)Na在空气中加热一段时间,将之投入水中,收集产生的气体于密闭容器中引燃,恰好完全反应,说明反应生成氢气与氧气,且二者物质的量之比为2:1,令氢气为2mol、氧气为1mol,根据方程式计算Na、过氧化钠的物质的量,再根据m=nM计算剩余的钠与生成的过氧化钠的质量比.
解答:
解:(1)在空气中加热的Na投入水中得到NaOH溶液,再加入100克质量分数为36.5%的盐酸溶液,恰好呈中性,则n(NaOH)=n(HCl)=
=1mol,根据Na元素守恒,则Na的质量为1mol×23g/mol=23g,
答:原来钠的质量为23g;
(2)Na在空气中加热一段时间,将之投入水中,收集产生的气体于密闭容器中引燃,恰好完全反应,说明反应生成氢气与氧气,由2H2+O2
2H2O可知,氢气、氧气的物质的量之比为2:1,令氢气为2mol、氧气为1mol,则:
2Na+2H2O=2NaOH+H2↑
4mol 2mol
2Na2O2+2H2O=4NaOH+O2↑
2mol 1mol
故剩余的钠与生成的过氧化钠的质量比=4mol×23g/mol:2mol×78g/mol=23:39,
答:剩余的钠与生成的过氧化钠的质量比为23:39.
| 100g×36.5% |
| 36.5g/mol |
答:原来钠的质量为23g;
(2)Na在空气中加热一段时间,将之投入水中,收集产生的气体于密闭容器中引燃,恰好完全反应,说明反应生成氢气与氧气,由2H2+O2
| ||
2Na+2H2O=2NaOH+H2↑
4mol 2mol
2Na2O2+2H2O=4NaOH+O2↑
2mol 1mol
故剩余的钠与生成的过氧化钠的质量比=4mol×23g/mol:2mol×78g/mol=23:39,
答:剩余的钠与生成的过氧化钠的质量比为23:39.
点评:本题考查化学方程式有关计算,难度不大,明确发生的反应即可解答.

练习册系列答案
相关题目
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A、NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) |
| B、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
| C、NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) |
| D、在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) |
下列化学反应属于吸热反应的是( )
| A、碘的升华 |
| B、生石灰溶于水 |
| C、镁和稀硫酸反应 |
| D、木炭和二氧化碳反应 |
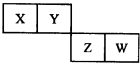 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
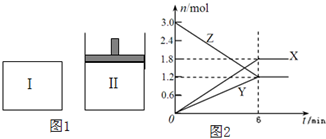 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |



