题目内容
把0.05mol NaOH晶体分别加入到自来水、0.5mol盐酸、0.5mol硫酸和0.5mol氯化镁溶液中,溶液导电性变化较大的是 .
考点:电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:溶液的导电能力与离子的浓度有关,与电解质的强弱无关;浓度越大导电能力越强,浓度越小导电能力越弱.
解答:
解:自来水中离子浓度较小,加入少量的氢氧化钠晶体后,离子浓度增大导电能力增强,故可选;
向盐酸溶液中加入NaOH晶体,盐酸和氢氧化钠反应生成氯化钠和水,电解质氯化氢转变为氯化钠,都是强电解质,溶液离子浓度变化不大,只是离子的转化,所以溶液导电能力变化不大,故不选;
向硫酸溶液中加入NaOH晶体,硫酸和氢氧化钠反应生成硫酸钠和水,电解质硫酸转变为硫酸钠,都是强电解质,溶液离子浓度变化不大,只是离子的转化,所以溶液导电能力变化不大,故不选;
向氯化镁溶液中加入NaOH晶体,氯化镁和NaOH反应生成氢氧化镁沉淀和NaCl,电解质氯化镁转变为NaCl,溶液导电能力变化不大,故不选.
故答案为:自来水.
向盐酸溶液中加入NaOH晶体,盐酸和氢氧化钠反应生成氯化钠和水,电解质氯化氢转变为氯化钠,都是强电解质,溶液离子浓度变化不大,只是离子的转化,所以溶液导电能力变化不大,故不选;
向硫酸溶液中加入NaOH晶体,硫酸和氢氧化钠反应生成硫酸钠和水,电解质硫酸转变为硫酸钠,都是强电解质,溶液离子浓度变化不大,只是离子的转化,所以溶液导电能力变化不大,故不选;
向氯化镁溶液中加入NaOH晶体,氯化镁和NaOH反应生成氢氧化镁沉淀和NaCl,电解质氯化镁转变为NaCl,溶液导电能力变化不大,故不选.
故答案为:自来水.
点评:本题考查的是影响导电能力大小的因素,导题目难度不大,电能力与离子的浓度有关,与电解质的强弱无关,挖掘隐含条件是解决本题的关键.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
下列热化学方程式中△H的绝对值能表示可燃物燃烧热的是( )
| A、H2(g)+Cl2(g)═2HCl(g);△H=-184.6kJ/mol | ||
B、CO(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol | ||
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ/mol |
下列说法正确的是( )
| A、蛋白质溶液中加入食盐会出现白色沉淀 |
| B、目前世界上最重要的矿物燃料是乙醇 |
| C、葡萄糖在人体内氧化分解属于吸热反应 |
| D、化学反应中的能量变化,只表现为热量的变化 |
下列化学反应属于吸热反应的是( )
| A、碘的升华 |
| B、生石灰溶于水 |
| C、镁和稀硫酸反应 |
| D、木炭和二氧化碳反应 |
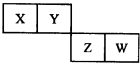 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
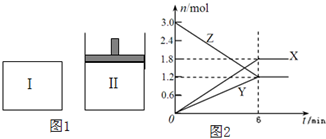 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |