题目内容
常温常压下,CO与H2的混合气体100mL,通入过量的O2,点燃后体积变为60mL,加入足量的NaOH溶液充分反应后,体积变为20mL,求原来混合气体中CO和H2各多少mL?(气体体积均在同温同压下测定的)
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:常温常压下,CO、H2混合气体通入过量的O2,点燃后体积变为60mL,生成的水为液态,60mL为二氧化碳与剩余氧气,再加入足量的NaOH溶液充分反应后,二氧化碳被吸收,剩余20mL为未反应的氧气,可以计算二氧化碳的体积,根据碳元素守恒计算CO的体积,进而计算氢气的体积.
解答:
解:CO、H2混合气体通入过量的O2,点燃后体积变为60mL,生成的水为液态,60mL为二氧化碳与剩余氧气,再加入足量的NaOH溶液充分反应后,二氧化碳被吸收,剩余20mL为未反应的氧气,故生成的二氧化碳为60mL-20mL=40mL,根据碳元素守恒,可知V(CO)=V(CO2)=40mL,故氢气的体积为100mL-40mL=60mL,
答:原来混合气体中CO为40mL,H2为60mL.
答:原来混合气体中CO为40mL,H2为60mL.
点评:本题考查混合物计算,难度不大,明确发生的反应即可解答,注意水为液态.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向NaHCO3溶液中滴加AlCl3溶液:Al3++3HCO3-═Al(OH)3↓+3CO2↑ |
| C、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、SO2气体通入Ba(NO3)2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
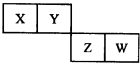 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |



