题目内容
化合物甲和乙均由两种短周期元素组成,甲、乙在一定条件下均能产生氢气,有关反应如下:甲+H2O=白色
沉淀N+H2;气体乙
气体G+H2.已知1.0g甲完全分解能产生1.12L标准状况下的H2;白色沉淀N可溶于NaOH溶液,气体G在标准状况下的密度为1.25g/L.
(1)写出白色沉淀N的化学式;
(2)列式计算气体G的摩尔质量;
(3)写出气体乙的结构式;
(4)甲与乙在一定条件下也能反应生成H2,写出有关反应的化学方程式.
沉淀N+H2;气体乙
| ||
(1)写出白色沉淀N的化学式;
(2)列式计算气体G的摩尔质量;
(3)写出气体乙的结构式;
(4)甲与乙在一定条件下也能反应生成H2,写出有关反应的化学方程式.
考点:无机物的推断
专题:计算题
分析:化合物甲和乙均由两种短周期元素组成,甲+H2O=白色沉淀N+H2,且白色沉淀N能溶于NaOH,可以判断该白色沉淀具有两性,故N是Al(OH)3,则甲中含有Al元素,1.0g甲完全分解能产生1.12L标准状况下的H2,则甲中还含有H元素,氢气物质的量为
=0.05mol,H元素质量为0.05mol×2g/mol=0.1g,故甲中Al元素质量为1g-0.1g=0.9g,故Al的物质的量为
=
mol,则甲中Al、H原子数目之比为
mol:0.05mol×2=1:3,故甲为AlH3;
G的摩尔质量为1.25g/L×22.4L/mol=28g/mol,结合气体乙
气体G+H2,判断气体G是氮气,则乙为NH3,据此解答.
| 1.12L |
| 22.4L/mol |
| 0.9g |
| 27g/mol |
| 1 |
| 30 |
| 1 |
| 30 |
G的摩尔质量为1.25g/L×22.4L/mol=28g/mol,结合气体乙
| ||
解答:
解:化合物甲和乙均由两种短周期元素组成,甲+H2O=白色沉淀N+H2,且白色沉淀N能溶于NaOH,可以判断该白色沉淀具有两性,故N是Al(OH)3,则甲中含有Al元素,1.0g甲完全分解能产生1.12L标准状况下的H2,则甲中还含有H元素,氢气物质的量为
=0.05mol,H元素质量为0.05mol×2g/mol=0.1g,故甲中Al元素质量为1g-0.1g=0.9g,故Al的物质的量为
=
mol,则甲中Al、H原子数目之比为
mol:0.05mol×2=1:3,故甲为AlH3;
G的摩尔质量为1.25g/L×22.4L/mol=28g/mol,结合气体乙
气体G+H2,判断气体G是氮气,则乙为NH3,
(1)由上述分析可知,N是Al(OH)3,
答:N的化学式为:Al(OH)3,
(2)G的摩尔质量为1.25g/L×22.4L/mol=28g/mol,
答:G的摩尔质量为28g/mol;
(3)由上述分析可知,气体乙为NH3,结构式为 ,
,
答:气体乙的结构式为 ;
;
(4)甲为AlH3,乙为NH3,一定条件下也能反应生成H2,反应方程式为:AlH3+3NH3=Al(NH2)3+3H2,
答:甲与乙的反应方程式为:AlH3+3NH3=Al(NH2)3+3H2.
| 1.12L |
| 22.4L/mol |
| 0.9g |
| 27g/mol |
| 1 |
| 30 |
| 1 |
| 30 |
G的摩尔质量为1.25g/L×22.4L/mol=28g/mol,结合气体乙
| ||
(1)由上述分析可知,N是Al(OH)3,
答:N的化学式为:Al(OH)3,
(2)G的摩尔质量为1.25g/L×22.4L/mol=28g/mol,
答:G的摩尔质量为28g/mol;
(3)由上述分析可知,气体乙为NH3,结构式为
 ,
,答:气体乙的结构式为
 ;
;(4)甲为AlH3,乙为NH3,一定条件下也能反应生成H2,反应方程式为:AlH3+3NH3=Al(NH2)3+3H2,
答:甲与乙的反应方程式为:AlH3+3NH3=Al(NH2)3+3H2.
点评:本题考查无机物推断,难度中等,需要学生熟练掌握元素化合物知识,具有一定的逻辑推理能力,(4)为易错点、难点,综合考查学生对知识的迁移应用,难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
下列有关物质性质的应用不正确的是( )
| A、常温下浓H2SO4能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| B、Cl2能与石灰乳反应,可用于制取漂白粉 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、石墨具有导电性,可用于制造半导体材料 |
在下列各溶液中,离子一定能大量共存的是( )
| A、室温下,pH=13的溶液中:K+、Al3+、Cl-、SO42- |
| B、含有1mol?L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、由水电离的c(H+)=10-12 mol?L-1的溶液中,K+、Na+、Cl-、SO4 |
| D、室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
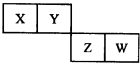 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |



