题目内容
13.某火力发电厂以煤为燃料,排出的废气中含有CO2、SO2、水蒸气.为检验该废气中的成分,用如图所示的装置进行实验: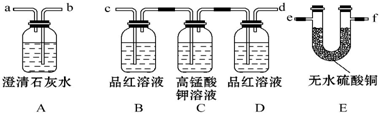
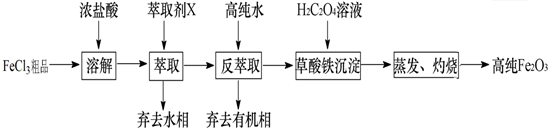
(1)仪器连接的顺序为(填导管接口字母)e-f-c-d-b;
(2)根据D中品红溶液不褪色,A中澄清石灰水变浑浊现象证明有CO2;
(3)装置B的作用是检验是否含SO2,装置D的作用是检验SO2是否被完全吸收.
分析 排出的废气中含有CO2、SO2、水蒸气.为检验该废气中的成分,先利用E检验水,再利用BCD组合装置检验并除去二氧化硫,最后利用A检验二氧化碳,以此来解答.
解答 解:排出的废气中含有CO2、SO2、水蒸气.为检验该废气中的成分,先利用E检验水,再利用BCD检验并除去二氧化硫,最后利用A检验二氧化碳,
(1)由上述分析可知,仪器连接的顺序为e-f-c-d-b,故答案为:e-f-c-d-b;
(2)由D中品红溶液不褪色,A中澄清石灰水变浑浊可知有CO2,故答案为:D中品红溶液不褪色,A中澄清石灰水变浑浊;
(3)装置B的作用是检验是否含SO2,装置D的作用是检验SO2是否被完全吸收,故答案为:检验是否含SO2;检验SO2是否被完全吸收.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意物质的检验顺序,题目难度不大.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
15.下列说法正确的是( )
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 | |
| D. | 向醋酸钠溶液中滴入酚酞试液,加热后溶液红色加深,说明盐类水解是放热的 |
18.下列变化不可能通过一步反应直接完成的是( )
| A. | Fe2O3→Fe(OH)3 | B. | Al(OH)3→Al2O3 | C. | SO3→H2SO4 | D. | Fe3+→Fe(OH)3 |
5.下列说法不正确的是( )
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
3.苹果汁中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色.若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
| A. | 氧化性 | B. | 还原性 | C. | 碱性 | D. | 酸性 |