题目内容
将2mol/l SO2和1mol/l的O2在在密闭容器中混合并在一定条件下反应2SO2+O2?2SO3若2s后测得SO3的浓度为0.6mol/l,则SO2平均化学反应速率为是( )
| A、v(SO2)=0.3 mol/(L?s) |
| B、v(SO2)=0.15 mol/(L?s) |
| C、v(SO2)=0.6 mol/(L?s) |
| D、v(SO2)=0.5 mol/(L?s) |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据化学反应速率计算公式计算出v(SO3),由于SO2和SO3的化学计量数相等,所以v(SO2)=v(SO3).
解答:
解:v(SO3)=
=0.3 mol/(L?s),
由于SO2和SO3的化学计量数相等,所以v(SO2)=v(SO3)=0.3 mol/(L?s).
故选A.
| 0.6mol/L |
| 2s |
由于SO2和SO3的化学计量数相等,所以v(SO2)=v(SO3)=0.3 mol/(L?s).
故选A.
点评:本题考查了化学反应速率的计算,难度不大,利用化学反应速率之比等于化学计量数之比进行计算可省去三段法分析,简化计算过程.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组溶液中的离子能大量共存,且向溶液中加入NaOH溶液时产生白色沉淀,加入盐酸时放出气体的一组是( )
| A、OH-Ba2+NO3-K+ |
| B、Na+ SO42- Cu2+ Cl- |
| C、HCO3- Cl- Na+ Ba2+ |
| D、Fe3+ Al3+ Br- NO3- |
下列说法中正确的是( )
| A、硅是人类将太阳能转变为电能的常用材料 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D、粗硅制备单晶硅不涉及氧化还原反应 |
NA为阿伏加德罗常数.则下列说法正确的是( )
| A、标准状况下,2.24L Cl2与热碱溶液完全反应生成Cl-和ClO3-转移了0.1NA e- |
| B、已知S-S键的键能为265kJ/mol,若使1mol某硫单质(气态)全部形成气态硫原子需要2120kJ能量,则3.2g这种硫单质中含S-S键的数目为0.1NA |
| C、0.1mol/L的FeBr3溶液中含0.3NA Br- |
| D、已知25℃,101kPa时气体摩尔体积为24.5L/mol.则此条件下0.05NA Fe与足量盐酸反应,产生H2约为1.225L |
反应P(g)+3Q(g)?2R(g)+2S(g),在不同情况下测得反应速率如下,其中反应速率最快的
是( )
是( )
| A、v(P)=0.15 mol/(L?min) |
| B、v(Q)=0.6 mol/(L?min) |
| C、v(R)=0.1 mol/(L?s) |
| D、v(S)=0.4 mol/(L?min) |
下列叙述正确的是( )
| A、摩尔是指物质所含的粒子个数,它是物质的数量单位 |
| B、阿伏加德罗常数通常用NA表示,6.02×1023mol称为阿伏加德罗常数 |
| C、氦气的摩尔质量是8g |
| D、4.4g二氧化碳气体中所含的原子个数与4.2g氮气中所含的原子个数相等 |
下列物质在水中的电离方程式错误的是( )
| A、NH4HCO3═NH4++HCO3- |
| B、Ba(NO3)2═Ba2++2NO3- |
| C、KAl(SO4)2═K++Al3++2SO42- |
| D、Ca(OH)2═Ca2++(OH)2- |
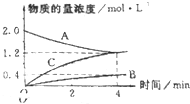 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答: