题目内容
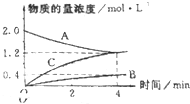 如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:
如图,曲线表示在800℃时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图象,试回答:(1)该反的反应物是
(2)4分钟时,C的浓度是B的
(3)该反应的化学方程式是
(4)反应开始至4分钟,若用A的浓度来表示该反应的平均速率为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断;
(2)根据图象可知4分钟时,C的浓度是1.2mol/L,B的浓度是0.4mol/L,据此答题;
(3)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式;
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=
计算A物质的平均反应速率.
(2)根据图象可知4分钟时,C的浓度是1.2mol/L,B的浓度是0.4mol/L,据此答题;
(3)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式;
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=
| △c |
| △t |
解答:
解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物,
故答案为:A;
(2)根据图象可知4分钟时,C的浓度是1.2mol/L,B的浓度是0.4mol/L,所以C的浓度是B的浓度的3倍,故答案为:3;
(3)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A
B+3C,
故答案为:2A
B+3C;
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=
=0.2mol/(L?min),
故答案为:0.2mol/(L?min).
故答案为:A;
(2)根据图象可知4分钟时,C的浓度是1.2mol/L,B的浓度是0.4mol/L,所以C的浓度是B的浓度的3倍,故答案为:3;
(3)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A
| 800℃ |
故答案为:2A
| 800℃ |
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=
| 0.8mol/L |
| 4min |
故答案为:0.2mol/(L?min).
点评:考查化学反应速率、浓度-时间图象等,注重基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
生活处处有化学,下列相关叙述中正确的是( )
| A、为提高粮食产量,应大量使用化肥和农药 |
| B、人体缺钙会引起骨质疏松症,因此钙元素摄入得越多越好 |
| C、自行车支架上刷上油漆既美观又能防止钢铁生锈 |
| D、人可以食用含黄曲霉素的变质食物 |
下列各组反应不能产生可燃性气体的是( )
| A、金属钠投入到乙醇中 |
| B、红热的木炭投入到热的浓硝酸中 |
| C、电石投入到水中CaC2 |
| D、加热溴乙烷与NaOH乙醇溶液的混合物 |
将3molA和2.5molB混合于容积为2L的密闭容器中,使其发生如下反应:3A(g)+B(g)═xC(g)+2D(g),经5分钟后,生成1molD.经测定5分钟内C的平均反应速率是0.1mol/(L?min),x的值( )
| A、1 | B、2 | C、3 | D、4 |
将2mol/l SO2和1mol/l的O2在在密闭容器中混合并在一定条件下反应2SO2+O2?2SO3若2s后测得SO3的浓度为0.6mol/l,则SO2平均化学反应速率为是( )
| A、v(SO2)=0.3 mol/(L?s) |
| B、v(SO2)=0.15 mol/(L?s) |
| C、v(SO2)=0.6 mol/(L?s) |
| D、v(SO2)=0.5 mol/(L?s) |
