题目内容
4.亚硝酸钠(NaNO2)在工业上多个领域有着广泛应用,也常用于鱼类、肉类等食品的染色和防腐.一般情况下,当人体一次性摄取超过300mg亚硝酸钠时,就会引起中毒,所以在食品行业用量有严格限制.某化学兴趣小组对亚硝酸钠进行多角度探究:(一)探究亚硝酸钠与硫酸反应及气体产物成分.
已知:①NO+NO2+2OH-═2NO2-+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
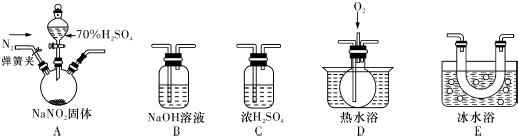
(1)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验的干扰.
(2)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、E、D、B.
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是D中通入氧气后,出现红棕色气体.
②装置E的作用是冷凝使NO2完全液化.
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O.
(二)亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2的方法:
(1)沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10.分别向盛有5mL 0.0001mol/L两种盐溶液的试管中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成沉淀的是装有NaCl溶液的试管.
(2)测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.该溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).
(三)泡菜中含有少量的亚硝酸盐.现取1kg泡菜榨汁,将榨出的液体收集后,经处理,使得到的泡菜汁中的亚硝酸盐都转化为亚硝酸钠.向得到的泡菜汁中加入过量的稀硫酸和碘化钾溶液,发生如下反应:
2NaNO2+2H2SO4+2KI=2NO↑+I2+K2SO4+Na2SO4+2H2O
经测定,反应后生成5.08g I2.
(1)则1kg泡菜中含有NaNO2的质量是2.76g.
(2)若一次食入0.1kg这种泡菜,是否会引起中毒?否(填“是”或“否”).
分析 (一)(1)根据各部分装置的作用进行连接,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮;
(2)NO很容易被氧气氧化,装置中有空气,无法检验有NO生成;
(3)根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断,温度低于二氧化氮液化温度时,二氧化氮变成液态;
(4)根据反应物和生成物写出反应方程式;
(二)(1)据溶度积小的沉淀先沉淀;
(2)NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;
(三)菜中含有少量的亚硝酸盐.现取1kg泡菜榨汁,将榨出的液体收集后,经处理,使得到的泡菜汁中的亚硝酸盐都转化为亚硝酸钠.向得到的泡菜汁中加入过量的稀硫酸和碘化钾溶液,发生如下反应:2NaNO2+2H2SO4+2KI=2NO↑+I2+K2SO4+Na2SO4+2H2O,反应后生成5.08g I2,根据化学方程式定量关系计算得到亚硝酸钠质量,当人体一次性摄取超过300mg亚硝酸钠时,就会引起中毒,据此判断是否会引起中毒.
解答 解:(一)(1)NO很容易被氧气氧化,装置中有空气,无法检验有NO生成,所以通氮气的目的是排尽整个装置中的空气,防止产生的NO被氧化生成NO2,
故答案为:防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验的干扰;
(2)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以装置的连接为A→C→E→D→B,
故答案为:E;D;B;
(3)①D中无色气体变成红色,说明含有NO气体,故答案为:D中通入氧气后,出现红棕色气体;
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,故答案为:冷凝使NO2完全液化;
(4)通过以上分析知,该反应中生成二氧化氮、一氧化氮,同时还有硫酸钠、水生成,所以反应方程式为2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O,
故答案为:2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O;
(二)(1)Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10,分别向盛有5mL 0.0001mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成AgCl沉淀;
故答案为:NaCl;
(2)由于亚硝酸钠溶液中存在水解平衡:NO2-+H2O=HNO2+OH-,所以亚硝酸钠溶液显示碱性,
故答案为:NO2-+H2O?HNO2+OH-;
(三)(1)设1kg菜汁中含有NaNO2的质量为y,2NaNO2+2H2SO4+2KI=2NO+I2+K2SO4+Na2SO4+2H2O
138 254
y 5.08g
y=2.76g,
故答案为:2.76;
(2)0.1kg泡菜中含有NaNO2的质量为2.76 g/kg×0.1 kg=0.276g=276mg,当人体一次性摄取超过300mg亚硝酸钠时,就会引起中毒
因为276mg<300mg,所以不会引起中毒,
故答案为:否.
点评 本题考查实验方案设计,明确物质的性质和实验原理是解本题关键,注意实验设计要遵循严密性、可行性、科学性的原则,题目难度较大.

| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v(D)=30 mol•L-1•min-1 |
| A. | 五氯化磷 | B. | 过氧化氢 | C. | 氟化氢 | D. | CCl4 |
 工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
工业上用N2和H2 合成NH3“N2(g)+3H2(g)═2NH3(g)△H<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:(1)已知:
N2(g)+O2(g)═2NO(g)△H=+a kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H=-b kJ•mol-1
2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1
若有34g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为(1.5c-a-b)kJ.
(2)合成NH3达到平衡后,某时刻改变下列条件A,在达到新平衡的过程中正反应速率始终增大.
A.升温 B.加压 C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如如图1所示:(图中T表示温度,n表示起始时H2物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.02 mol•L-1.
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如表:
 | 1小时 | 2 小时 | 3小时 | 4小时 |
| T3 | 30% | 50% | 80% | 80% |
| T4 | 35% | 60% | a | b |
(5)向绝热、恒容的密闭容器中通入H2、N2使其在一定条件下合成NH3,请在图2中画出平衡常数K随时间的变化曲线.
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3•H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③=④ |
 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )| A. | 当溶液pH=3.76时,c(CH3COOH)>c(CH3COO-) | |
| B. | 当溶液pH=4.76时,c(CH3COO-)=c(CH3COOH)>c(OH-)=c(H+) | |
| C. | 当溶液pH=5.76时,CH3COO-的物质的量分数约为0.91 | |
| D. | 当溶液3<pH<7时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=10(pH-pKa) |
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚与碳酸钠溶液反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]+$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
| A. | AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-═Ag2S↓ | |
| B. | 向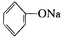 溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- 溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |