题目内容
13.在一定温度下的密闭容器中,发生反应:A(s)+2B(g)═2C(g)+D(g),下列说法正确的是( )| A. | 保持体积不变充入He气,体系压强增大,平衡逆向移动 | |
| B. | 保持压强不变充入He气,因为体系压强不变,所以平衡不移动 | |
| C. | 其它条件不变,向体系中加入A,A的转化率减小,B的转化率增大 | |
| D. | 其它条件不变,改变体积使压强改变,逆方向的速率改变的程度大于正方向 |
分析 A.体积不变时充入He氦气,各组分的浓度不变,则平衡不移动;
B.保持压强不变充入He气,则容器的容积增大,各组分的浓度发生变化,平衡发生移动;
C.A为固体,向体系中加入A,平衡不移动;
D.该反应的正反应为体积增大的反应,改变压强后
解答 解:A.保持体积不变充入He气,体系压强增大,但各组分的浓度不变,反应速率和浓度不会不会,则平衡不移动,故A错误;
B.保持压强不变充入He气,容器的容积增大,各组分的浓度减小,平衡向着逆向移动,故B错误;
C.A的状态为固体,向体系中加入A,平衡不发生移动,故C错误;
D.其它条件不变,改变体积使压强改变,由于该反应的正反应为气体体积增大的反应,则逆方向的速率改变的程度大于正方向,故D正确;
故选D.
点评 本题考查了影响化学平衡的因素,题目难度中等,明确影响化学平衡的因素为解答关键,A、B为易错点,注意压强、容器容积不变时充入稀有气体,对化学平衡产生的影响不同.

练习册系列答案
相关题目
13.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 实验室常用Al2(SO4)3溶液与氨水溶液制备Al(OH)3沉淀 | Al(OH)3不溶于碱 |
| B | NaHCO3为强碱弱酸盐 | NaHCO3溶液显碱性 |
| C | SO2具有氧化性 | SO2可用品红溶液检验 |
| D | 明矾水解产生具有吸附性的胶体 | 明矾可作自来水消毒 |
| A. | A | B. | B | C. | C | D. | D |
14.将下列铁的化合物溶于盐酸,滴加KSCN溶液后颜色变化最不明显的是( )
| A. | FeO | B. | Fe3O4 | C. | Fe2O3 | D. | Fe(OH)3 |
1.某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度.
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
则V1=40mL,V2=10mL.
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度.
实验步骤:
i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCI3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ii.向甲中滴加CCl4,充分振荡;
iii.向乙中滴加试剂X.
①将KI和FeCl3反应的离子方程式补充完整.
2I-+2Fe3+?1I2+2Fe2+
②步骤iii中,试剂X是KSCN溶液.
③步骤ii和iii中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是ii中可观察到溶液分层,下层呈现紫红色,iii中可观察到溶液变红.
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率.
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度.
实验步骤:
i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCI3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ii.向甲中滴加CCl4,充分振荡;
iii.向乙中滴加试剂X.
①将KI和FeCl3反应的离子方程式补充完整.
2I-+2Fe3+?1I2+2Fe2+
②步骤iii中,试剂X是KSCN溶液.
③步骤ii和iii中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是ii中可观察到溶液分层,下层呈现紫红色,iii中可观察到溶液变红.
18.将固体NH4I置于某体积不变的密闭容器中,在某温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g),平衡时,c(HI)=6mol•L-1,c(H2)=1mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 36 | B. | 49 | C. | 48 | D. | 64 |
2.已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8℃,沸点是44.8℃.
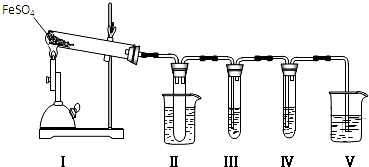
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固;
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4、6mol•L-1 NaOH、0.5mol•L-1 BaCl2、0.5mol•L-1 Ba(NO3)2、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
(3)也有同学认为可以通过检验试管中残留固体证明分解产物.方案如下:
取适量残留固体于试管中,加入足量稀硫酸,将所得溶液分为两份.向第一份溶液中滴加硫氰化钾溶液,若变红,证明分解产物中有氧化铁;向第二份溶液滴加酸性高锰钾溶液,若褪色证明分解产物中有氧化亚铁.
①写出第一份溶液中反应的离子方程式Fe3++3SCN-?Fe(SCN)3;
②有同学认为高锰酸钾溶液褪色不能说明分解产物有氧化亚铁,理由是如果FeSO4未完全分解,溶液里也存在Fe2+.

(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固;
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4、6mol•L-1 NaOH、0.5mol•L-1 BaCl2、0.5mol•L-1 Ba(NO3)2、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5mol.L-1BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水). |
取适量残留固体于试管中,加入足量稀硫酸,将所得溶液分为两份.向第一份溶液中滴加硫氰化钾溶液,若变红,证明分解产物中有氧化铁;向第二份溶液滴加酸性高锰钾溶液,若褪色证明分解产物中有氧化亚铁.
①写出第一份溶液中反应的离子方程式Fe3++3SCN-?Fe(SCN)3;
②有同学认为高锰酸钾溶液褪色不能说明分解产物有氧化亚铁,理由是如果FeSO4未完全分解,溶液里也存在Fe2+.
3.下列物质中属于电解质的是( )
| A. | 二氧化碳 | B. | 银 | C. | 烧碱溶液 | D. | NaCl |
