题目内容
18.将固体NH4I置于某体积不变的密闭容器中,在某温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g),平衡时,c(HI)=6mol•L-1,c(H2)=1mol•L-1,则此温度下反应①的平衡常数为( )| A. | 36 | B. | 49 | C. | 48 | D. | 64 |
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数k=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=6mol•L-1,HI分解生成的H2的浓度为1mol•L-1.
NH4I分解生成的HI的浓度为6mol•L-1+2×1mol•L-1=8mol•L-1,所以NH4I分解生成的NH3的浓度为8mol•L-1,
所以反应①的平衡常数k=c(NH3)•c(HI)=8mol•L-1×6mol•L-1=48mol2•L-2.
故选C.
点评 本题的解题关键在于平衡时HI为NH4I分解生成的HI与分解的HI之差,注意两个平衡的关系,题目难度中等.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
18.能用组成元素的单质直接反应得到的物质是( )
| A. | NO 2 | B. | FeCl2 | C. | SO3 | D. | FeCl3 |
13.在一定温度下的密闭容器中,发生反应:A(s)+2B(g)═2C(g)+D(g),下列说法正确的是( )
| A. | 保持体积不变充入He气,体系压强增大,平衡逆向移动 | |
| B. | 保持压强不变充入He气,因为体系压强不变,所以平衡不移动 | |
| C. | 其它条件不变,向体系中加入A,A的转化率减小,B的转化率增大 | |
| D. | 其它条件不变,改变体积使压强改变,逆方向的速率改变的程度大于正方向 |
3.将0.5mol SO2和0.2mol O2置于密闭容器中发生反应:2SO2+O2$?_{催化剂}^{高温}$ 2SO3.下列关于该反应的说法正确的是( )
| A. | 最终可生成0.4 mol SO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
7.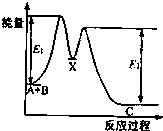 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
8.在水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、CO32- | D. | K+、NO3-、OH-、SO42- |

 回答下列问题
回答下列问题
