题目内容
氮的循环涉及到多种化学物质.(如图1中的W、M、X、Y、Z均是化学物质)

(1)由N2→X是工业合成氨的反应,写出其化学方程式 .
(2)写出Y、M的化学式 、 .
(3)X可与HNO3反应,产物可用作氮肥,写出X与HNO3反应的化学方程式 .
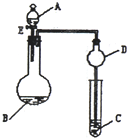
(4)某同学利用如2图装置将氨气与氧化铜反应,验证氨气的性质并验证部分产物(部分未画出)发现反应确实能发生,且反应后得到三种物质,其中有两种单质.
请回答下列问题:
①实验室制取氨气的化学方程式是 .
②从氨中N元素的化合价角度看,该同学想证明的是氨的 性质,实验中观察到的 现象则能够证明氨具有这个性质.
③B装置的作用是 .
④A中反应的化学方程式是 .

(1)由N2→X是工业合成氨的反应,写出其化学方程式
(2)写出Y、M的化学式
(3)X可与HNO3反应,产物可用作氮肥,写出X与HNO3反应的化学方程式
(4)某同学利用如2图装置将氨气与氧化铜反应,验证氨气的性质并验证部分产物(部分未画出)发现反应确实能发生,且反应后得到三种物质,其中有两种单质.
请回答下列问题:
①实验室制取氨气的化学方程式是
②从氨中N元素的化合价角度看,该同学想证明的是氨的
③B装置的作用是
④A中反应的化学方程式是
考点:氨的化学性质,氮族元素简介
专题:
分析:依据流程转化关系分析判断,W为H2,X为NH3,Y为NO,Z为NO2,M为H2O;
(1)氮气和氢气高温高压催化剂反应生成氨气;
(2)依据上述分析判断得到物质组成;
(3)X和硝酸反应生成硝酸铵;
(4)①实验室制备氨气是利用氯化铵固体和氢氧化钙固体加热反应生成;
②依据氨气和氧化铜发生反应是氨气的还原性,发生反应生成红色铜;
③利用硫酸铜遇到水变蓝色证明反应生成水;
④氧化铜氧化氨气生成氮气、铜和水;
(1)氮气和氢气高温高压催化剂反应生成氨气;
(2)依据上述分析判断得到物质组成;
(3)X和硝酸反应生成硝酸铵;
(4)①实验室制备氨气是利用氯化铵固体和氢氧化钙固体加热反应生成;
②依据氨气和氧化铜发生反应是氨气的还原性,发生反应生成红色铜;
③利用硫酸铜遇到水变蓝色证明反应生成水;
④氧化铜氧化氨气生成氮气、铜和水;
解答:
解:(1)氮气和氢气高温高压催化剂反应生成氨气,反应的化学方程式为:N2+3H2
2NH3;
故答案为;N2+3H2
2NH3;
(2)依据上述分析判断得到物质组成,Y、M的化学式NO、H2O;
故答案为:NO、H2O;
(3)X和硝酸反应生成硝酸铵,反应的化学方程式为:NH3+HNO3═NH4NO3;
故答案为:NH3+HNO3═NH4NO3;
(4)①实验室制备氨气是利用氯化铵固体和氢氧化钙固体加热反应生成,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
②依据氨气和氧化铜发生反应是氨气的还原性,发生反应生成红色铜;
故答案为:还原性;A中黑色粉状固体逐渐变成亮红色固体,
③B装置的作用是利用硫酸铜遇到水变蓝色证明反应生成水
故答案为:验证氨气和氧化铜反应后产物中的水;
④氧化铜氧化氨气生成氮气、铜和水,反应的化学方程式为:2NH3+3CuO
N2↑+3Cu+3H2O;
故答案为:2NH3+3CuO
N2↑+3Cu+3H2O;
| ||
| 高温高压 |
故答案为;N2+3H2
| ||
| 高温高压 |
(2)依据上述分析判断得到物质组成,Y、M的化学式NO、H2O;
故答案为:NO、H2O;
(3)X和硝酸反应生成硝酸铵,反应的化学方程式为:NH3+HNO3═NH4NO3;
故答案为:NH3+HNO3═NH4NO3;
(4)①实验室制备氨气是利用氯化铵固体和氢氧化钙固体加热反应生成,反应的化学方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②依据氨气和氧化铜发生反应是氨气的还原性,发生反应生成红色铜;
故答案为:还原性;A中黑色粉状固体逐渐变成亮红色固体,
③B装置的作用是利用硫酸铜遇到水变蓝色证明反应生成水
故答案为:验证氨气和氧化铜反应后产物中的水;
④氧化铜氧化氨气生成氮气、铜和水,反应的化学方程式为:2NH3+3CuO
| ||
故答案为:2NH3+3CuO
| ||
点评:本题考查了氨气实验室制备方法,氮及其化合物性质的分析应用,主要是氨气性质和制备的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
将氯气溶于草木灰的浸出液所得溶液比氯水的漂白能力强而且无逸出氯气的有害作用.请你根据所学知识判断下列说法错误的是( )
| A、碳酸的酸性弱于盐酸,但强于次氯酸 |
| B、氯气通入草木灰的溶液中发生反应2K2CO3+Cl2+H2O═2KHCO3+KCl+KClO |
| C、氯气通入草木灰的溶液中发生反应K2CO3+Cl2+H2O═KHCO3+KCl+HClO |
| D、草木灰溶液本身不具有漂白作用,但具有去污作用 |
有关化学用语表达正确的是( )
A、聚苯乙烯的结构简式: | ||||
B、S2-的结构示意图: | ||||
C、
| ||||
D、过氧化氢电子式: |
有关物质用途,用离子方程式解释不正确的是( )
| A、氢氟酸刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O |
| B、明矾用于净水:Al3++3H2O=Al(OH)3+3H+ |
| C、纯碱去除油污:CO32-+H2O?HCO3-+OH- |
| D、氯气制备“84”消毒液:Cl2+2OH-=Cl-+ClO-+H2O |
以下说法不正确的是( )
| A、绿色食品是指不含任何化学物质的食品 |
| B、硅是制造太阳能电池的常用材料 |
| C、SiO2、SO2均属酸性氧化物 |
| D、光导纤维是以二氧化硅为主要原料制成的 |
已知HA为酸性略强于醋酸的一元弱酸,则在0.1mol?L-1 NaA溶液中,离子浓度关系正确的是( )
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(A-)+c(OH-) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)>c(OH-)>c(A-)>c(H+) |
下列物质长久放置在空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A、浓硫酸的质量增加 |
| B、铝的表面生成致密的氧化物薄膜 |
| C、澄清的石灰水变浑浊 |
| D、氢氧化钠固体发生潮解 |
 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题: