题目内容
已知HA为酸性略强于醋酸的一元弱酸,则在0.1mol?L-1 NaA溶液中,离子浓度关系正确的是( )
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(A-)+c(OH-) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)>c(OH-)>c(A-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:HA为酸性略强于醋酸的一元弱酸,NaA为强碱弱酸盐,A-水解导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,据此答题;
解答:
解:A.NaA为强碱弱酸盐,A-水解导致溶液呈碱性,则c(H+)<c(OH-),A-水解、钠离子不水解,所以c(Na+)>c(A-),A-水解程度较小,则溶液中离子浓度大小顺序是c(Na+)>c(A-)>c(OH-)>c(H+),故A错误;
B.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故B正确;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),溶液呈碱性,钠离子不水解,所以c(Na+)+c(OH-)>c(A-)+c(H+),故C错误;
D.根据A知,c(OH-)<c(A-),故D错误;
故选B.
B.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),故B正确;
C.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-),溶液呈碱性,钠离子不水解,所以c(Na+)+c(OH-)>c(A-)+c(H+),故C错误;
D.根据A知,c(OH-)<c(A-),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,明确盐的特点结合“谁强谁显性、谁弱谁水解”来分析解答,注意守恒思想的运用,题目难度不大.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离的C(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO3- | ||
C、
| ||
| D、c(Fe3+)=0.1mol?L-1的溶液中:K+、SO42-、CO32-、Cl- |
室温下,下列溶液中粒子的物质的量浓度关系正确的是( )
| A、O.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(0H-) |
| B、O.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
| C、pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、浓度均为0.1 mol/L的①NH4Cl②NH4Al(SO4)2③NH4HCO3三种溶液,其中c(NH4+):③>①>② |
下列关于氯的说法错误的是( )
| A、氯水、液氯中均含有Cl2分子,故两者均为黄绿色 | ||||
B、
| ||||
| C、Cl2可以使湿润的有色布条褪色,是因为Cl2有漂白性 | ||||
| D、氯水中分子由多到少的顺序是:H2O>Cl2>HClO |
实验是研究化学的基础,如图中所示的实验方法、装置或操作均正确的是( )
A、 浓硫酸稀释 |
B、 除去CO2中混有的杂质气体(HCl) |
C、 分离出AgNO3溶液中的AgCl |
D、 称量32.6g的NaOH固体 |

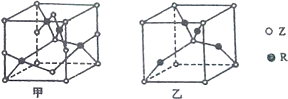 已知元素W、X、Y、Z、R为前四周期元素,且原子序数依次增大.元素W的负一价阴离子与某惰性气体结构相同,X是形成化合物种类最多的元素,Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素W、X、Y、Z、R为前四周期元素,且原子序数依次增大.元素W的负一价阴离子与某惰性气体结构相同,X是形成化合物种类最多的元素,Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题: