题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑十2H2O |
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
C、向水杨酸( )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
| D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、浅绿色是Fe2+离子的颜色,所以该离子方程式书写违背客观事实;
B、酸性溶液中不可能产生OH-,与客观事实不符;
C、向水杨酸( )中滴加NaHCO3溶液,只有羧基的酸性比碳酸的酸性强,而酚羟基的酸较碳酸要弱得多,所以酚羟基与NaHCO3溶液不反应;
)中滴加NaHCO3溶液,只有羧基的酸性比碳酸的酸性强,而酚羟基的酸较碳酸要弱得多,所以酚羟基与NaHCO3溶液不反应;
D、在多组离子反应中,少的量定多的用量,以此分析离子方程式的正误.
B、酸性溶液中不可能产生OH-,与客观事实不符;
C、向水杨酸(
 )中滴加NaHCO3溶液,只有羧基的酸性比碳酸的酸性强,而酚羟基的酸较碳酸要弱得多,所以酚羟基与NaHCO3溶液不反应;
)中滴加NaHCO3溶液,只有羧基的酸性比碳酸的酸性强,而酚羟基的酸较碳酸要弱得多,所以酚羟基与NaHCO3溶液不反应;D、在多组离子反应中,少的量定多的用量,以此分析离子方程式的正误.
解答:
解:A、方程式书写违背客观事实,正确的离子反应为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故A错误;
B、与客观事实不符,正确的离子反应为:5I-+IO3-+6H+═3I2+3H2O,故B错误;
C、向水杨酸( )中滴加NaHCO3溶液,放出无色气体,正确的离子反应为
)中滴加NaHCO3溶液,放出无色气体,正确的离子反应为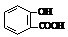 +HCO3-→
+HCO3-→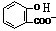 +CO2↑+H2O,故C错误;
+CO2↑+H2O,故C错误;
D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合,两者的量比为1:2,如果设NH4Al(SO4)2为1mol,则Ba(OH)2为2mol,1mol的NH4Al(SO4)2电离出1molNH4+、1molAl3+和2molSO42-,而2mol的Ba(OH)2电离出2molBa2+和4molOH-,4molOH-先跟1molNH4+反应消耗1mol,还有3molOH-,恰好与1molAl3+生成1molAl(OH)3,正确的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选D.
B、与客观事实不符,正确的离子反应为:5I-+IO3-+6H+═3I2+3H2O,故B错误;
C、向水杨酸(
 )中滴加NaHCO3溶液,放出无色气体,正确的离子反应为
)中滴加NaHCO3溶液,放出无色气体,正确的离子反应为 +HCO3-→
+HCO3-→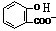 +CO2↑+H2O,故C错误;
+CO2↑+H2O,故C错误;D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合,两者的量比为1:2,如果设NH4Al(SO4)2为1mol,则Ba(OH)2为2mol,1mol的NH4Al(SO4)2电离出1molNH4+、1molAl3+和2molSO42-,而2mol的Ba(OH)2电离出2molBa2+和4molOH-,4molOH-先跟1molNH4+反应消耗1mol,还有3molOH-,恰好与1molAl3+生成1molAl(OH)3,正确的离子反应为NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O,故D正确;
故选D.
点评:本题考查离子方程式的书写,题目难度适中,书写时应综合考虑微粒的酸性强弱和反应的先后顺序,以及是否符合反应实际的角度分析.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
下列有关化学平衡移动叙述,正确的是( )
A、 可逆反应:Cr2O72-+H2O?2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如图 |
B、 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42-(蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图 |
C、 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如图 |
D、 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图 |
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ/mol下列说法正确的是( )
| A、使用催化剂可以提高SO2的转化率 |
| B、增大O2的浓度可以提高反应速率和SO2的转化率 |
| C、反应450℃时的平衡常数小于500℃时的平衡常数 |
| D、2mol SO2(g)和1mol O2(g)所含的总能量小于2mol SO3(g)所含的总能量 |
下列液体均处于25℃,有关叙述正确的是( )
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | ||
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的102倍 | ||
| C、常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | ||
D、常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中
|
小苏打溶液中滴加酚酞试液显红色,关于小苏打水溶液的表述正确的是( )
| A、c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) |
| B、c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-) |
| C、HCO3- 的电离程度大于HCO3-的水解程度 |
| D、存在的电离平衡有:HCO3-?H++CO32-,H2O?H++OH- |
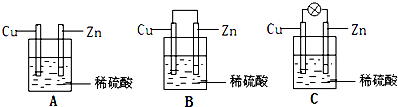
 能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式