题目内容
实验是研究化学的基础,试回答以下问题:
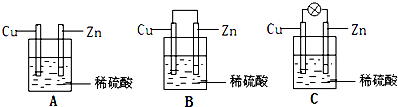
(1)①把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片(见图A),可观察到铜片 (填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图B),组成一个原电池,负极为 ,正极的电极反应式为 ;
②如果烧杯中最初装入的是500mL 2mol/L的稀硫酸溶液,构成铜锌原电池(见图C,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)= mol/L c(ZnSO4)= mol/L;
(2)下列实验操作中正确的是 ;
A.将含有甲烷、乙烯的混合气体通入酸性KMnO4溶液,可以提纯乙烯
B.向溴水中加入乙醇,充分振荡,可以将溴水中的Br2萃取出来
C.向淀粉溶液中加入少量稀硫酸,加热4~5min,待溶液冷却后加入含氢氧化钠的氢氧化铜悬浊液,加热至沸腾,若未见砖红色沉淀生成,说明淀粉未水解
D.向含有少量乙酸的乙酸乙酯混合液中加入饱和Na2CO3溶液,可以除去乙酸
(3)实验室以动物脂肪为原料可以制取肥皂,请写出硬脂酸甘油酯发生皂化反应的化学方程式 ;
(4)蛋白质在一定条件下可以转化为氨基酸,氨基酸具有两性,其中显酸性的官能团名称是 ,显碱性的官能团名称是 ;
(5)现有A、B、C三种烷烃,它们的分子式都为C5H12
①若A的一氯代物只有一种结构,则A的结构简式是 ;
②若B无支链,则B的结构简式是 ;
③C的习惯命名为 .

(1)①把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片(见图A),可观察到铜片
②如果烧杯中最初装入的是500mL 2mol/L的稀硫酸溶液,构成铜锌原电池(见图C,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=
(2)下列实验操作中正确的是
A.将含有甲烷、乙烯的混合气体通入酸性KMnO4溶液,可以提纯乙烯
B.向溴水中加入乙醇,充分振荡,可以将溴水中的Br2萃取出来
C.向淀粉溶液中加入少量稀硫酸,加热4~5min,待溶液冷却后加入含氢氧化钠的氢氧化铜悬浊液,加热至沸腾,若未见砖红色沉淀生成,说明淀粉未水解
D.向含有少量乙酸的乙酸乙酯混合液中加入饱和Na2CO3溶液,可以除去乙酸
(3)实验室以动物脂肪为原料可以制取肥皂,请写出硬脂酸甘油酯发生皂化反应的化学方程式
(4)蛋白质在一定条件下可以转化为氨基酸,氨基酸具有两性,其中显酸性的官能团名称是
(5)现有A、B、C三种烷烃,它们的分子式都为C5H12
①若A的一氯代物只有一种结构,则A的结构简式是
②若B无支链,则B的结构简式是
③C的习惯命名为
考点:原电池和电解池的工作原理,电解原理,油脂的性质、组成与结构,氨基酸、蛋白质的结构和性质特点,化学实验方案的评价
专题:电化学专题,有机反应
分析:(1)①锌比铜活泼,铜与稀硫酸不反应,形成原电池时,锌为负极,被氧化,铜为正极,正极发生还原反应生成氢气;
②正极发生2H++2e-=H2↑,负极发生Zn-2e-=Zn2+,根据生成氢气的物质的量可计算转移电子的物质的量,以此可计算相关物质的浓度;
(2)A.乙烯被氧化生成二氧化碳气体;
B.乙醇和水混溶;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行;
D.乙酸乙酯不溶于饱和碳酸钠溶液.
(3)硬脂酸甘油酯在碱性条件下水解生成硬质酸钠和甘油;
(4)氨基酸含有氨基和羧基两种官能团,其中氨基具有碱性,羧基具有酸性;
(5)根据戊烷有正戊烷、新戊烷和异戊烷三种同分异构体进行判断.
②正极发生2H++2e-=H2↑,负极发生Zn-2e-=Zn2+,根据生成氢气的物质的量可计算转移电子的物质的量,以此可计算相关物质的浓度;
(2)A.乙烯被氧化生成二氧化碳气体;
B.乙醇和水混溶;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行;
D.乙酸乙酯不溶于饱和碳酸钠溶液.
(3)硬脂酸甘油酯在碱性条件下水解生成硬质酸钠和甘油;
(4)氨基酸含有氨基和羧基两种官能团,其中氨基具有碱性,羧基具有酸性;
(5)根据戊烷有正戊烷、新戊烷和异戊烷三种同分异构体进行判断.
解答:
解:(1)①锌比铜活泼,铜与稀硫酸不反应,形成原电池时,锌为负极,被氧化,铜为正极,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:没有;锌;2H++2e-=H2↑;
②正极发生2H++2e-=H2↑,负极发生Zn-2e-=Zn2+,
n(H2)=
=0.5mol,则转移1mol电子,
由电极方程式可知消耗n(Zn)=0.5mol,n(H+)=1mol,
则c(H2SO4)=
=1mol/L,
c( ZnSO4)=
=1mol/L,
故答案为:1;1;
(2)A.乙烯被氧化生成二氧化碳气体,引入新的杂质,应用溴水,故A错误;
B.乙醇和水混溶,不能用作萃取剂,应用苯或四氯化碳,故B错误;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行,应在水解之后加入碱调节溶液至碱性,故C错误;
D.乙酸乙酯不溶于饱和碳酸钠溶液,可用于饱和碳酸钠溶液分离,故D正确;
故答案为:D;
(3)硬脂酸甘油酯与氢氧化钠反应生成C17H35COONa与甘油,反应方程式为 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+ .
.
故答案为: +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+ ;
;
(4)氨基酸含有氨基和羧基两种官能团,其中氨基具有碱性,羧基具有酸性,故答案为:羧基;氨基;
(5)戊烷有正戊烷、新戊烷和异戊烷三种同分异构体,
①若A的一氯代物只有一种结构,则应为新戊烷,结构简式为 ,故答案为:
,故答案为: ;
;
②若B无支链,应为正戊烷,结构简式为CH3(CH2)3CH3,故答案为:CH3(CH2)3CH3;
③戊烷只有3种同分异构体,则C应为异戊烷,故答案为:异戊烷.
故答案为:没有;锌;2H++2e-=H2↑;
②正极发生2H++2e-=H2↑,负极发生Zn-2e-=Zn2+,
n(H2)=
| 11.2L |
| 22.4L/mol |
由电极方程式可知消耗n(Zn)=0.5mol,n(H+)=1mol,
则c(H2SO4)=
| 0.5L×2mol/L-0.5mol |
| 0.5L |
c( ZnSO4)=
| 0.5mol |
| 0.5L |
故答案为:1;1;
(2)A.乙烯被氧化生成二氧化碳气体,引入新的杂质,应用溴水,故A错误;
B.乙醇和水混溶,不能用作萃取剂,应用苯或四氯化碳,故B错误;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行,应在水解之后加入碱调节溶液至碱性,故C错误;
D.乙酸乙酯不溶于饱和碳酸钠溶液,可用于饱和碳酸钠溶液分离,故D正确;
故答案为:D;
(3)硬脂酸甘油酯与氢氧化钠反应生成C17H35COONa与甘油,反应方程式为
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+ .
.故答案为:
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+ ;
;(4)氨基酸含有氨基和羧基两种官能团,其中氨基具有碱性,羧基具有酸性,故答案为:羧基;氨基;
(5)戊烷有正戊烷、新戊烷和异戊烷三种同分异构体,
①若A的一氯代物只有一种结构,则应为新戊烷,结构简式为
 ,故答案为:
,故答案为: ;
;②若B无支链,应为正戊烷,结构简式为CH3(CH2)3CH3,故答案为:CH3(CH2)3CH3;
③戊烷只有3种同分异构体,则C应为异戊烷,故答案为:异戊烷.
点评:本题考查较为综合,涉及原电池,化学实验方案的评价以及有机物的推断等知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意把握原电池的工作原理以及有机物的结构和性质,注意相关基础知识的积累,难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目
下列有关实验装置进行的相应实验,能达到实验目的是( )


| A、用装置①除去Cl2中含有的少量HCl |
| B、用装置②从NaCl溶液中蒸发结晶获得NaCl晶体 |
| C、用装置③除去CO中混有的少量CO2 |
| D、用装置④实验室制取并收集氨气 |
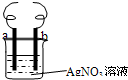 用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )
用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )| A、构成原电池时b极反应为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少 |
| D、构成的原电池或电解池工作后都会产生大量气体 |
设NA 表示阿伏加德罗常数,则下列叙述正确的是( )
| A、1mol羟基(-OH)含有10NA个电子 |
| B、在18gH218O中含有10NA个中子 |
| C、标准状况下,22.4L四氯化碳含有NA个四氯化碳分子 |
| D、室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
下列表示对应化学反应的离子方程式正确的是( )
| A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑十2H2O |
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
C、向水杨酸( )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
| D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
 运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义