题目内容
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有 和 .
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
①哪一时间段反应速率最大 (填“0~1min”或“1~2min”或“2~3min”或“3~4min”或“4~5min”).
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为 .
③试分析1~3min时间段里,反应速率变大的主要原因 .
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为
③试分析1~3min时间段里,反应速率变大的主要原因
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)温度升高、浓度增大,可增大反应速率;
(2)①一段时间内收集的气体的体积越大,反应速率越大;
②根据v=
计算;
③开始反应时浓度逐渐变小,但温度逐渐升高.
(2)①一段时间内收集的气体的体积越大,反应速率越大;
②根据v=
| △c |
| △t |
③开始反应时浓度逐渐变小,但温度逐渐升高.
解答:
解:(1)当加热或加入浓盐酸后,反应速率明显加快,说明温度升高、浓度增大,可增大反应速率,则影响化学反应速率的因素有温度和浓度,故答案为:温度;浓度;
(2)①2~3min收集的气体的体积比其它时间段体积增大的大,则说明该时间段反应速率最大,故答案为:2~3min;
②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=
=0.005mol,则消耗n(HCl)=0.01mol,v=
=
=0.1mol.L-1.min-1,
故答案为:0.1mol.L-1.min-1;
③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素,故答案为:反应放热成为影响速率的主要因素.
(2)①2~3min收集的气体的体积比其它时间段体积增大的大,则说明该时间段反应速率最大,故答案为:2~3min;
②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=
| 0.112L |
| 22.4L/mol |
| △c |
| △t |
| ||
| 1min |
故答案为:0.1mol.L-1.min-1;
③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素,故答案为:反应放热成为影响速率的主要因素.
点评:本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
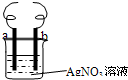 用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )
用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )| A、构成原电池时b极反应为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少 |
| D、构成的原电池或电解池工作后都会产生大量气体 |
下列表示对应化学反应的离子方程式正确的是( )
| A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑十2H2O |
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
C、向水杨酸( )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
| D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
下列表示对应化学反应的离子方程式正确的是( )
| A、氯化铵固体与消石灰反应制备氨气:NH4++OH-=NH3↑+H2O | ||||
B、用石墨棒作电极电解饱和食盐水:Cl-+Na+
| ||||
| C、硫酸铝溶液与过量氨水反应的离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
 以固体氧化物电解池通过电解方式分解氮氧化物,不使用还原剂,避免还原剂引起的二次污染.当以Pt作电极时,固体氧化物电解池还原NO示意图如图所示,298K时,有关实验数据如下(化学反应消耗的电能占总电能的80%).
以固体氧化物电解池通过电解方式分解氮氧化物,不使用还原剂,避免还原剂引起的二次污染.当以Pt作电极时,固体氧化物电解池还原NO示意图如图所示,298K时,有关实验数据如下(化学反应消耗的电能占总电能的80%).