题目内容
4.海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用.(1)下列有关海水综合利用的说法中正确的是C
A.只需通过物理变化,可从海水中得到钾单质
B.海水通过蒸发可得到淡水,通过蒸馏可得到粗盐
C.从海水中可制取溴及其化工产品
D.利用潮汐发电是将化学能转化为电能
(2)海水中丰富的氯化钠是重要的化工原料,写出工业上用NaCl制备金属钠的化学方程式2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑
(3)若用石墨作电极电解饱和食盐水,阳极电极反应式2Cl--2e-=Cl2↑,阴极电极反应式2H++2e-=H2↑,电解的总反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,用平衡的原理解释在阴极区溶液显碱性的原因因为H+在阴极放电,使H+浓度减少,破坏了水的电离平衡,水的电离平衡向正反应移动,使OH-浓度增大,溶液显碱性
(4)若用石墨作电极电解氢氧化钠溶液,则电解池的阴极电极反应式为4H++4e-=2H2↑,阳极电极反应式为4OH--4e-=2H2O+O2↑.
分析 (1)A.可从化合价的变化思考;
B.海水中通过蒸发提取粗盐;
C.自然界中溴元素主要存在海水中;
D.根据能量转化的方式分析;
(2)工业上用电解熔融的NaCl制备金属钠,电解熔融的氯化钠生成钠与氯气;
(3)氯离子在阳极放电生成氯气,氢离子在阴极放电生成氢气;阴极阳离子放电,结合溶液中的阳离子分析;
(4)惰性电极电解氢氧化钠溶液,阴极阳离子得电子,阳极阴离子失电子.
解答 解:(1)A.海水中含有的钾元素是以K+的形式存在,要转化为钾单质,钾元素必然降价,要发生还原反应,即只经过物理变化不能从海水中得到钾单质,故A正确;
B.海水中含有氯化钠,经过海水蒸发制得氯化钠,不是蒸馏,故B错误;
C.自然界中溴元素主要存在海水中,所以从海水中可制取溴及其化工产品,故C正确;
D.利用朝汐发电是朝汐能转化为电能,没有发生化学反应,而化学能转化为电能必须要发生化学反应,故D错误;
故选C;
2)工业上用电解熔融的NaCl制备金属钠,电解熔融的氯化钠生成镁与氯气,反应化学方程式为2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,
故答案为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
(3)阳极发生氧化反应,氯离子在阳极放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,氢离子在阴极得电子生成氢气,电极反应为2H++2e-=H2↑,电解的总反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;阴极阳离子放电,溶液中的阳离子有钠离子和氢离子,氢离子得电子能力大于钠离子,在氢离子在阳极得电子,溶液中的氢离子由水电离,H+在阴极放电,使H+浓度减少,破坏了水的电离平衡,水的电离平衡向正反应移动,使OH-浓度增大,溶液显碱性;
故答案为:2Cl--2e-=Cl2↑;2H++2e-=H2↑;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;因为H+在阴极放电,使H+浓度减少,破坏了水的电离平衡,水的电离平衡向正反应移动,使OH-浓度增大,溶液显碱性;
(4)惰性电极电解氢氧化钠溶液,阴极阳离子得电子,即氢离子在阴极得电子生成氢气,其电极方程式为:4H++4e-=2H2↑,阳极阴离子失电子,即氢氧根离子在阴极上失电子生成氧气,则阴极的电极方程式为:4OH--4e-=2H2O+O2↑;
故答案为:4H++4e-=2H2↑;4OH--4e-=2H2O+O2↑.
点评 本题考查海水资源的综合利用、电解原理的应用等,题目难度中等,注意根据氧化还原反应理解电解池原理以及电极反应方程式的书写方法.

 阅读快车系列答案
阅读快车系列答案| A. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3产生的CO2多 | |
| B. | 等物质的量的盐酸分别与足量的Na2CO3和NaHCO3反应,Na2CO3产生的CO2多 | |
| C. | 相同温度在水中的溶解度:Na2CO3大于NaHCO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,消耗盐酸的量一样多 |
| A. | Fe2+的水溶液为浅绿色 | |
| B. | Fe3+的水溶液为黄色 | |
| C. | Fe3+具有氧化性,Fe2+具有还原性 | |
| D. | Fe3+溶液中滴入含KSCN-的溶液,立即出现红色沉淀 |
| A. | 2CO (g )+O2(g )═2CO2 (g )△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l )△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l )△H=-571.6kJ•mol-1 | |
| D. | H2(g )+Cl2 (g )═2HCl (g)△H=-184.6kJ•mol-1 |
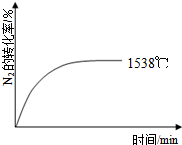 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
| A. | 10mL | B. | 15mL | C. | 25mL | D. | 30mL |
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙酸乙酯(乙酸) | NaOH | 分液 |
| C | CH3CH2OH (H2O) | CaO | 蒸馏 |
| D | 肥皂(甘油) | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 植物油是高分子化合物 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生水解和氧化反应 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
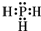 ;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.
;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.