题目内容
15.磷化铝是用红磷和铝粉烧制而成.因杀虫效率高、经济方便而应用广泛.可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片).(1)写出磷化铝的化学式:AlP;举一例红磷的同素异形体,写出其化学式:P4.
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:AlP+3H2O=Al(OH)3+PH3↑.
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:
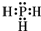 ;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.
;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:PH3+4Cu2++4H2O=8H++H3PO4+4Cu.(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是不同,重铬酸钾和PH3是氧化还原反应,活性炭是吸附能力,HI和PH3是化合反应生成PH4I.
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10•6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10•6H2O═Na3HP2O7+X+5H2O,请你推出X的化学式:Na2HPO4;并且写出X溶液中离子电荷守恒的等式:c(Na+)+c(H+)=2c(HPO${\;}_{4}^{2-}$)+c(H2PO${\;}_{4}^{-}$)+3c(PO${\;}_{4}^{3-}$)+c(OH-).
分析 (1)磷化铝中磷为非金属元素,显-3价,铝为金属元素,显+3价;由同种元素形成的不同单质为同素异形体;
(2)AlP和水反应时,生成H3P和Al(OH)3沉淀,据此分析;
(3)根据NH3的结构写出磷化氢的电子式;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,根据得失电子数守恒和质量守恒来书写反应方程式;
(4)PH3是一种强还原性、碱性的气体,据此分析;
(5)根据化学方程式要满足质量守恒来分析;
解答 解:(1)磷化铝中磷为非金属元素,显-3价,铝为金属元素,显+3价,故磷化铝的化学式为AlP;由同种元素形成的不同单质为同素异形体,故红磷的同素异形体为白磷P4,故答案为:AlP,P4;
(2)AlP和水反应时,生成H3P和Al(OH)3沉淀,化学方程式为:AlP+3H2O=Al(OH)3+PH3↑,故答案为:AlP+3H2O=Al(OH)3+PH3↑;
(3)NH3的结构中3个H原子和N原子间形成3条共价键,而磷化氢的结构和氨气结构类似,故磷化氢的电子式为: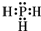 ;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,根据得失电子数守恒和质量守恒来可知反应方程式为:PH3+4Cu2++4H2O=8H++H3PO4+4Cu,故答案为:
;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,根据得失电子数守恒和质量守恒来可知反应方程式为:PH3+4Cu2++4H2O=8H++H3PO4+4Cu,故答案为: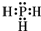 ;PH3+4Cu2++4H2O=8H++H3PO4+4Cu;
;PH3+4Cu2++4H2O=8H++H3PO4+4Cu;
(4)PH3是一种强还原性、碱性的气体,遇重铬酸钾发生氧化还原反应,还能被活性炭吸附,能和HI化合生成PH4I,故原理不同,故答案为:不同,重铬酸钾和PH3是氧化还原反应,活性炭是吸附能力,HI和PH3是化合反应生成PH4I;
(5)根据化学方程式要满足质量守恒可知,X的化学式为Na2HPO4,HPO4-是酸式弱酸根,在溶液中既能电离为PO43-又能水解为H2PO4-和H3PO4,故溶液中的阳离子有:
Na+和H+,阴离子有OH-、PO43-、HPO42-、H2PO4-,故根据电荷守恒可知:c(Na+)+c(H+)=2c(HPO${\;}_{4}^{2-}$)+c(H2PO${\;}_{4}^{-}$)+3c(PO${\;}_{4}^{3-}$)+c(OH-),故答案为:Na2HPO4;c(Na+)+c(H+)=2c(HPO${\;}_{4}^{2-}$)+c(H2PO${\;}_{4}^{-}$)+3c(PO${\;}_{4}^{3-}$)+c(OH-).
点评 本题是一道知识的迁移运用题目,根据学生非常熟悉的氨气的性质来迁移到PH3的性质,难度不大,应注意的是同一主族元素及其化合物的性质的相似性和递变性.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
| A. | 乙烷 | B. | 甲苯 | C. | 氯乙烯 | D. | 丙烯 |
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
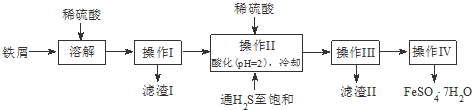
查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.
 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+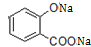 +H2O.
+H2O.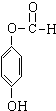 ;
;