题目内容
13.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择不正确的是( )| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙酸乙酯(乙酸) | NaOH | 分液 |
| C | CH3CH2OH (H2O) | CaO | 蒸馏 |
| D | 肥皂(甘油) | NaCl | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯和苯酚互溶,苯酚能和浓溴水发生取代反应生成溴苯,溴苯和苯能互溶,苯酚和NaOH溶液反应生成可溶性的苯酚钠,苯和氢氧化钠溶液不反应;
B.乙酸乙酯和乙酸都能和NaOH反应,乙酸和饱和碳酸钠反应,乙酸乙酯和饱和碳酸钠溶液不反应;
C.水与CaO反应,增大与乙醇的沸点差异;
D.加NaCl降低肥皂的溶解度,发生盐析.
解答 解:A.苯和苯酚互溶,苯酚能和浓溴水发生取代反应生成溴苯,溴苯和苯能互溶,苯酚和NaOH溶液反应生成可溶性的苯酚钠,苯和氢氧化钠溶液不反应,所以不能用浓溴水除杂,应该用NaOH溶液除杂然后采用分液方法分离,故A错误;
B.乙酸乙酯和乙酸都能和NaOH反应,乙酸和饱和碳酸钠反应,乙酸乙酯和饱和碳酸钠溶液不反应,所以除杂剂应该选取饱和的碳酸钠溶液,然后采用分液方法分离,故B错误;
C.水与CaO反应,增大与乙醇的沸点差异,然后蒸馏可除杂,故C正确;
D.加NaCl降低肥皂的溶解度,发生盐析,然后过滤可除杂,故D正确;
故选AB.
点评 本题考查除杂,为高频考点,把握物质的性质差异性、混合物分离方法为解答的关键,侧重分析与实验能力的考查,除杂时不能引进新的杂质且操作要简便.

练习册系列答案
相关题目
3.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 乙烷 | B. | 甲苯 | C. | 氯乙烯 | D. | 丙烯 |
1.下列关于氧化还原反应的叙述正确的是( )
| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
8.下列表示物质结构的化学用语或模型正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 聚丙烯的结构简式为: |
5.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
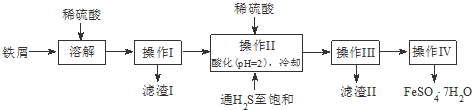
查询资料,得25℃时有关物质的数据如下表:
(1)操作II中,先通入硫化氢至饱和,目的是除去溶液中的Sn2+离子;后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.

查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.
2.下列物质中,属于电解质的是( )
| A. | 蔗糖 | B. | 饱和食盐水 | C. | 盐酸 | D. | KOH |
3.电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程.下图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极.下列有关描述错误的是( )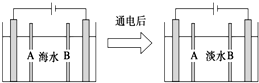

| A. | 阳离子交换膜是A,不是B | |
| B. | 通电后阳极区的电极反应式:2Cl--2e-═Cl2↑ | |
| C. | 工业上阴极使用铁丝网代替石墨碳棒,增大反应接触面 | |
| D. | 阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀 |
 .
.