题目内容
16.配制250mL1mol/L的HCl溶液,需要10mol/L HCl溶液的体积为( )| A. | 10mL | B. | 15mL | C. | 25mL | D. | 30mL |
分析 根据溶液稀释时,溶质的物质的量不变来列式计算即可.
解答 解:设需要10mol/L浓盐酸的体积为VmL,溶液稀释前后溶质物质的量不变,
则10mol/L×VmL=1mol/L×250mL,
解得V=25.0mL,
故选:C.
点评 本题考查溶液的稀释计算,学生应把握溶液稀释前后溶质的物质的量不变是解答的关键.

练习册系列答案
相关题目
6.下列与NaHSO3溶液有关的离子方程式书写错误的是( )
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
11.下列化学实验基本操作正确的是( )
①把烧杯放在铁圈上直接加热;
②点燃可燃性气体前,不一定要先检验气体纯度;
③给试管里的液体加热,液体的体积应该超过试管容积的$\frac{2}{3}$;
④用完酒精灯,必须用灯帽盖灭,不可用嘴去吹灭;
⑤制取氧气结束后,应立刻把装反应物的试管用冷水冲洗干净;
⑥进行细铁丝在氧气中燃烧的实验之前,要预先在集气瓶中装少量的水.
①把烧杯放在铁圈上直接加热;
②点燃可燃性气体前,不一定要先检验气体纯度;
③给试管里的液体加热,液体的体积应该超过试管容积的$\frac{2}{3}$;
④用完酒精灯,必须用灯帽盖灭,不可用嘴去吹灭;
⑤制取氧气结束后,应立刻把装反应物的试管用冷水冲洗干净;
⑥进行细铁丝在氧气中燃烧的实验之前,要预先在集气瓶中装少量的水.
| A. | ①和② | B. | ②和④ | C. | ④和⑥ | D. | ③和⑤ |
1.下列关于氧化还原反应的叙述正确的是( )
| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
8.下列表示物质结构的化学用语或模型正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 聚丙烯的结构简式为: |
5.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
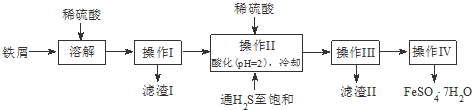
查询资料,得25℃时有关物质的数据如下表:
(1)操作II中,先通入硫化氢至饱和,目的是除去溶液中的Sn2+离子;后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.

查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
③判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
④若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是:部分Fe2+被空气中O2氧化.
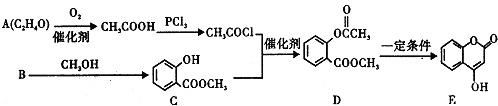
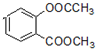 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.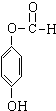 ;
;
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.