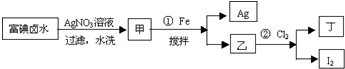
题目内容
1.15g金属钠跟水反应,得到100ml溶液,试计算:
(1)生成的气体在标准状况下的体积是多少升?
(2)反应后所得溶液的物质的量浓度是多少?
(3)若把1.15g金属钠在氧气中燃烧,得到产物的质量是多少?
(1)生成的气体在标准状况下的体积是多少升?
(2)反应后所得溶液的物质的量浓度是多少?
(3)若把1.15g金属钠在氧气中燃烧,得到产物的质量是多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算1.15g金属钠的物质的量,根据方程式计算生成氢气的物质的量、生成NaOH的物质的量,
(1)根据V=nVm计算氢气的体积;
(2)根据c=
计算氢氧化钠溶液的浓度;
(3)钠在氧气中燃烧生成Na2O2,根据Na原子守恒计算过氧化钠物质的量,再根据m=nM计算过氧化钠质量.
| m |
| M |
(1)根据V=nVm计算氢气的体积;
(2)根据c=
| n |
| V |
(3)钠在氧气中燃烧生成Na2O2,根据Na原子守恒计算过氧化钠物质的量,再根据m=nM计算过氧化钠质量.
解答:
解:1.15g金属钠的物质的量为
=0.05mol,则:
2Na+2H2O=2NaOH+H2↑
2 2 1
0.05mol n(NaOH) n(H2)
所以n(NaOH)=n(Na)=0.05mol,n(H2)=
n(Na)=0.025mol,
(1)生成氢气的体积为0.025mol×22.4L/mol=0.56L,
答:氢气的体积为0.56L.
(2)所得NaOH溶液的物质的浓度是
=0.5mol/L,
答:所得NaOH溶液的物质的浓度是0.5mol/L.
(3)钠在氧气中燃烧生成Na2O2,根据Na原子守恒,可知n(Na2O2)=
n(Na)=0.025mol,则m(Na2O2)=0.025mol×78g/mol=1.95g,
答:生成过氧化钠的质量为1.95g.
| 1.15g |
| 23g/mol |
2Na+2H2O=2NaOH+H2↑
2 2 1
0.05mol n(NaOH) n(H2)
所以n(NaOH)=n(Na)=0.05mol,n(H2)=
| 1 |
| 2 |
(1)生成氢气的体积为0.025mol×22.4L/mol=0.56L,
答:氢气的体积为0.56L.
(2)所得NaOH溶液的物质的浓度是
| 0.05mol |
| 0.1L |
答:所得NaOH溶液的物质的浓度是0.5mol/L.
(3)钠在氧气中燃烧生成Na2O2,根据Na原子守恒,可知n(Na2O2)=
| 1 |
| 2 |
答:生成过氧化钠的质量为1.95g.
点评:本题主要考查根据方程式进行的有关计算,比较基础,旨在考查学生对基础知识的理解掌握,清楚发生的反应是关键.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
下列叙述中,错误的是( )
| A、硅是构成岩石和许多矿物的基本元素 |
| B、硅胶可用作催化剂的载体和袋装食品的干燥剂 |
| C、水玻璃可用作制备木材防火剂的原料 |
| D、二氧化硅的化学性质很不活泼,不能与强碱反应生成盐 |
下列物质之间的反应因反应条件不同或反应用量不同,而产物不发生改变的是( )
| A、钠与氧气反应 |
| B、铁在氯气中燃烧 |
| C、氯化铝溶液与氢氧化钠溶液 |
| D、二氧化碳与氢氧化钙溶液 |
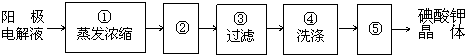
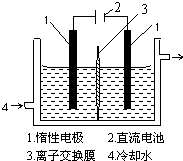 在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.
在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.