题目内容
 在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.
在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.【实验一】在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
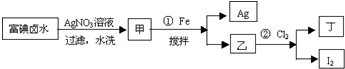
(1)步骤①加Fe的目的是
(2)写出步骤②的离子方程式
(3)上述生产流程中,可以利用的副产物是
(4)分离I2和丁的方法是
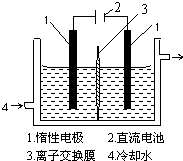
【实验二】电解制取KIO3,电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
(5)电解时,阳极上发生反应的电极反应式为
【实验三】电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
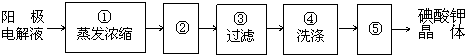
(6)步骤②的操作名称
考点:海水资源及其综合利用,电解原理
专题:电化学专题,化学应用
分析:实验一:富碘卤水中含有I-,加入硝酸银发生:Ag++I-═AgI↓,过滤水洗后的甲为AgI,加入Fe搅拌,可得Ag和FeI2,向其中通Cl2,发生2FeI2+3Cl2═2I2+2FeCl3,由于加入的Fe过量,所以先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液.分离I2和FeCl3溶液方法是加入苯、汽油、CCl4等有机溶剂进行萃取,以此解答该题;
实验二:阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,阴极上氢离子放电生成氢气;
实验三:从热溶液中析出晶体的方法是冷却结晶;洗涤后的晶体要进行干燥;洗涤晶体的目的:洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
实验二:阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,阴极上氢离子放电生成氢气;
实验三:从热溶液中析出晶体的方法是冷却结晶;洗涤后的晶体要进行干燥;洗涤晶体的目的:洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
解答:
解:(1)富碘卤水中含有I-,加入硝酸银发生:Ag++I-═AgI↓,过滤水洗后的甲为AgI,加入Fe搅拌,可得Ag和FeI2,
故答案为:使碘化银转化成碘化亚铁(FeI2)和单质银;
(2)FeI2具有还原性,与充足的氯气发生氧化还原反应生成I2和FeCl3,反应的离子方程式为2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
(3)由流程图可看出,副产物为Ag,由于加入的Fe过量,所以先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液,
故答案为:Ag;
(4)丁为FeCl3,分离I2和FeCl3溶液方法是加入苯、汽油、CCl4等有机溶剂进行萃取,故答案为:萃取;
(5)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,电极方程式为I-+6OH--6e-=IO3-+3H2O,阴极上氢离子放电生成氢气,所以阴极现象:有气泡产生,破坏水的电离平衡正向进行,溶液中氢氧根离子浓度增大,PH增大;
故答案为:2I--2e-=I2 或I-+6OH--6e-=IO3-+3H2O;变大;
(6)从热溶液中析出晶体的方法是:冷却结晶;洗涤后的晶体有水分,所以要进行干燥;过滤后得到的晶体上吸附部分氢氧化钾等杂质,为得到较纯净的碘酸钾晶体,所以要进行洗涤.
故答案为:冷却结晶;洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
故答案为:使碘化银转化成碘化亚铁(FeI2)和单质银;
(2)FeI2具有还原性,与充足的氯气发生氧化还原反应生成I2和FeCl3,反应的离子方程式为2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-;
(3)由流程图可看出,副产物为Ag,由于加入的Fe过量,所以先加入稀硫酸除去Fe,再加入稀硝酸与Ag反应制得AgNO3溶液,
故答案为:Ag;
(4)丁为FeCl3,分离I2和FeCl3溶液方法是加入苯、汽油、CCl4等有机溶剂进行萃取,故答案为:萃取;
(5)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,电极方程式为I-+6OH--6e-=IO3-+3H2O,阴极上氢离子放电生成氢气,所以阴极现象:有气泡产生,破坏水的电离平衡正向进行,溶液中氢氧根离子浓度增大,PH增大;
故答案为:2I--2e-=I2 或I-+6OH--6e-=IO3-+3H2O;变大;
(6)从热溶液中析出晶体的方法是:冷却结晶;洗涤后的晶体有水分,所以要进行干燥;过滤后得到的晶体上吸附部分氢氧化钾等杂质,为得到较纯净的碘酸钾晶体,所以要进行洗涤.
故答案为:冷却结晶;洗去吸附在碘酸钾晶体上的氢氧化钾等杂质.
点评:本题考查了碘的物理性质、电解原理、碘离子的检验等性质,难度不大,明确酸性条件下碘离子和碘酸根离子能生成碘单质,碱性条件下,碘能和氢氧根离子生成碘离子和碘酸根离子.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
下列有关物质或应用正确的是( )
| A、在常温下可用铝制容器贮藏运输浓硫酸 |
| B、单质硅可用于制造光纤和太阳能电池 |
| C、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D、氢氧化钠用于治疗胃溃疡病人的胃酸过多症 |
下列关于平衡常数的说法正确的是( )
| A、一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B、改变外界条件使化学平衡状态改变时,平衡常数也一定改变 |
| C、对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| D、对于反应2NO2(g)?N2O4(g)正反应的平衡常数为K1,逆反应的平衡常数为K2,K1=K2 |
下列离子方程式正确的是( )
| A、将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓ |
| B、KMnO4与浓盐酸反应制Cl2:2MnO4-+16HCl=2Mn2++6Cl-+5Cl2↑+8H2O |
| C、0.1 mol Cl2和100 mL 1 mol/L FeBr2反应:3Cl2+2Fe2++4Br -=6Cl-+2Fe3++2Br2 |
| D、用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O |