��Ŀ����
���Ż�����ʶ����ǿ�������ԴԽ��Խ�����ǹ�ע��
��1�������ڶ�ʮһ�����п�����������Դ��̨�ϳ�Ϊһ�־������صĶ�����Դ��
����-��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
I��SO2+2H2O+I2=H2SO4+2HI
��2HI?H2+I2
��2H2SO4=2SO2+O2+2H2O
����������Ӧ�������ж���ȷ���� ������ţ���ͬ����
a����Ӧ�����ڳ����½��� b����ӦI��SO2�����Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�������в���l mol O2��ͬʱ����1mol H2
�����ü�����ˮ��Ӧ�Ʊ���������ԭ�ϼ��������ʸߣ�����ʵ���ƹ��ֵ����֪�÷�ӦΪ��
CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1kJ?mol-1
��800��ʱ����Ӧ��ƽ�ⳣ��K1=1.0��ijʱ�̲�ø��¶��£��ܱ������и����ʵ����ʵ���Ũ�ȷֱ�Ϊ��c��CH4��=3.0mol?L-1��c��H2O��=8.5mol?L-1��c��CO��=2.0mol?L-1��c��H2��=2.0mol?L-1�����ʱ���淴Ӧ���ʵĹ�ϵ��v�� v���������������������=����
��ʵ������Zn��ϡ������ȡH2���������������й����Լ��е� ������H2�����ʽ�����
a��NaNO3 b��CuSO4�� c��Na2SO4 d��NaHSO3
��2���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���
CO��g��+2H2��g��?CH3OH��g��
�����÷�Ӧ���ش��������⣺
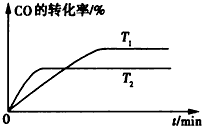
����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߣ�T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1 K2�������������������=����
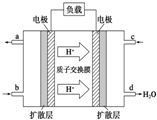
����֪�״�ȼ�ϵ�صĹ���ԭ����ͼ��ʾ���õ�ع���ʱ��b��ͨ�������Ϊ ���õ�������ĵ缫��ӦʽΪ�� ������һ��ʱ���6.4g�״���CH3OH����ȫ��Ӧ����CO2ʱ���� mol���ӷ���ת�ƣ�
��1�������ڶ�ʮһ�����п�����������Դ��̨�ϳ�Ϊһ�־������صĶ�����Դ��
����-��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
I��SO2+2H2O+I2=H2SO4+2HI
��2HI?H2+I2
��2H2SO4=2SO2+O2+2H2O
����������Ӧ�������ж���ȷ����
a����Ӧ�����ڳ����½��� b����ӦI��SO2�����Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�������в���l mol O2��ͬʱ����1mol H2
�����ü�����ˮ��Ӧ�Ʊ���������ԭ�ϼ��������ʸߣ�����ʵ���ƹ��ֵ����֪�÷�ӦΪ��
CH4��g��+H2O��g��=CO��g��+3H2��g����H=+206.1kJ?mol-1
��800��ʱ����Ӧ��ƽ�ⳣ��K1=1.0��ijʱ�̲�ø��¶��£��ܱ������и����ʵ����ʵ���Ũ�ȷֱ�Ϊ��c��CH4��=3.0mol?L-1��c��H2O��=8.5mol?L-1��c��CO��=2.0mol?L-1��c��H2��=2.0mol?L-1�����ʱ���淴Ӧ���ʵĹ�ϵ��v��
��ʵ������Zn��ϡ������ȡH2���������������й����Լ��е�
a��NaNO3 b��CuSO4�� c��Na2SO4 d��NaHSO3
��2���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״���
CO��g��+2H2��g��?CH3OH��g��
�����÷�Ӧ���ش��������⣺
����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߣ�T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1

����֪�״�ȼ�ϵ�صĹ���ԭ����ͼ��ʾ���õ�ع���ʱ��b��ͨ�������Ϊ

���㣺ת�������¶ȡ�ѹǿ�ı仯����,��ѧ��Դ���͵��,��ѧƽ�⽨���Ĺ���,��ѧƽ���Ӱ������
ר�⣺�����������������
��������1����a�����᳣�����¶ȣ����ֽ⣻
b����Ӧ�ж���������ֻ�ԭ�ԣ������Ա�HIǿ��
c��1molSO2����2molH2O����1molH2SO4��1molH2SO4�ֽ�����1molSO2��1molH2O��
d���ɢ��֪����lmolO2��ͬʱ����2molSO2����I��֪2molSO2����4molHI���ɢ��֪4molHI�ֽ�����2mol H2��
�ڼ����Ũ���µ��ܶȻ�Qc����ƽ�ⳣ��k=1�Ƚϣ���Qc=1������ƽ��״̬����Qc��1��ƽ�����淴Ӧ�ƶ�����Qc��1��������Ӧ�ƶ���
�����������ӵ�Ũ�ȡ����ȡ��γ�ԭ��صȿ��Լӿ췴Ӧ���ʣ�
��2�����¶�Խ�߷�Ӧ����Խ�죬����ƽ��ʱ��Խ�̣���T1��T2���¶�Խ��CO��ת����ԽС�������¶�ƽ�����淴Ӧ�ƶ���
�������ӵĶ����ƶ���֪���缫Ϊȼ�ϵ�صĸ������Ҳ�缫Ϊȼ�ϵ�ص���������������������Ӧ���״��ڸ����ŵ磬������Ӧ��ԭ��Ӧ�������������ŵ磬�����缫��ӦʽΪCH3OH��l��+H2O��l��-6e-=CO2��g��+6H+��������ӦʽΪO2+4e-+4H+=2H2O��6.4g�״���CH3OH�������ʵ���Ϊ
=0.2mol�����ݵ缫��Ӧʽ����ת�Ƶ��ӵ����ʵ�����
b����Ӧ�ж���������ֻ�ԭ�ԣ������Ա�HIǿ��
c��1molSO2����2molH2O����1molH2SO4��1molH2SO4�ֽ�����1molSO2��1molH2O��
d���ɢ��֪����lmolO2��ͬʱ����2molSO2����I��֪2molSO2����4molHI���ɢ��֪4molHI�ֽ�����2mol H2��
�ڼ����Ũ���µ��ܶȻ�Qc����ƽ�ⳣ��k=1�Ƚϣ���Qc=1������ƽ��״̬����Qc��1��ƽ�����淴Ӧ�ƶ�����Qc��1��������Ӧ�ƶ���
�����������ӵ�Ũ�ȡ����ȡ��γ�ԭ��صȿ��Լӿ췴Ӧ���ʣ�
��2�����¶�Խ�߷�Ӧ����Խ�죬����ƽ��ʱ��Խ�̣���T1��T2���¶�Խ��CO��ת����ԽС�������¶�ƽ�����淴Ӧ�ƶ���
�������ӵĶ����ƶ���֪���缫Ϊȼ�ϵ�صĸ������Ҳ�缫Ϊȼ�ϵ�ص���������������������Ӧ���״��ڸ����ŵ磬������Ӧ��ԭ��Ӧ�������������ŵ磬�����缫��ӦʽΪCH3OH��l��+H2O��l��-6e-=CO2��g��+6H+��������ӦʽΪO2+4e-+4H+=2H2O��6.4g�״���CH3OH�������ʵ���Ϊ
| 6.4g |
| 32g/mol |
���
�⣺��1����a�����᳣�����¶ȣ����ֽ⣬��a����
b����Ӧ�ж���������ֻ�ԭ�ԣ������Ա�HIǿ����b����
c��1molSO2����2molH2O����1molH2SO4��1molH2SO4�ֽ�����1molSO2��1molH2O��ѭ����ˮ�������٣���Ӧ����ˮ����c��ȷ��
d���ɢ��֪����lmolO2��ͬʱ����2molSO2����I��֪2molSO2����4molHI���ɢ��֪4molHI�ֽ�����2mol H2����ѭ�������в���l mol O2��ͬʱ����2mol H2����d����
��ѡ��c��
��Ũ����Qc=
=0.6��1������ƽ��������Ӧ�ƶ�����v����v������ѡ������
��a������NaNO3��������Ũ�Ȳ��䣬���������������������ʣ���a����
b������CuSO4���γ�ԭ��أ��ӿ��������������ʣ���b��ȷ��
c������Na2SO4��������Ũ�Ȳ��䣬���������������������ʣ���c����
d������NaHSO3���������ӷ�Ӧ��������Ũ�Ƚ��ͣ��������������ʽ��ͣ���d����
�ʴ�Ϊ�����ң�b��
��2�����¶�Խ�߷�Ӧ����Խ�죬����ƽ��ʱ��Խ�̣���T1��T2���¶�Խ��CO��ת����ԽС�������¶�ƽ�����淴Ӧ�ƶ����¶�ƽ�ⳣ�����ͣ��¶�Խ��ƽ�ⳣ��ԽС����K1��K2��
�ʴ�Ϊ������
�������ӵĶ����ƶ���֪���缫Ϊȼ�ϵ�صĸ������Ҳ�缫Ϊȼ�ϵ�ص���������������������Ӧ���״��ڸ����ŵ磬��bͨ��CH3OH��������Ӧ��ԭ��Ӧ�������������ŵ磬������ӦʽΪO2+4e-+4H+=2H2O��6.4g�״���CH3OH�������ʵ���Ϊ
=0.2mol���ɸ����缫��ӦʽΪCH3OH+H2O-6e-=CO2+6H+��֪ת�Ƶ��ӵ����ʵ���Ϊ0.2mol��6=1.2mol��
�ʴ�Ϊ��CH3OH��O2+4e-+4H+=2H2O��1.2��
b����Ӧ�ж���������ֻ�ԭ�ԣ������Ա�HIǿ����b����
c��1molSO2����2molH2O����1molH2SO4��1molH2SO4�ֽ�����1molSO2��1molH2O��ѭ����ˮ�������٣���Ӧ����ˮ����c��ȷ��
d���ɢ��֪����lmolO2��ͬʱ����2molSO2����I��֪2molSO2����4molHI���ɢ��֪4molHI�ֽ�����2mol H2����ѭ�������в���l mol O2��ͬʱ����2mol H2����d����
��ѡ��c��
��Ũ����Qc=
| 23��2 |
| 3��8.5 |
��a������NaNO3��������Ũ�Ȳ��䣬���������������������ʣ���a����
b������CuSO4���γ�ԭ��أ��ӿ��������������ʣ���b��ȷ��
c������Na2SO4��������Ũ�Ȳ��䣬���������������������ʣ���c����
d������NaHSO3���������ӷ�Ӧ��������Ũ�Ƚ��ͣ��������������ʽ��ͣ���d����
�ʴ�Ϊ�����ң�b��
��2�����¶�Խ�߷�Ӧ����Խ�죬����ƽ��ʱ��Խ�̣���T1��T2���¶�Խ��CO��ת����ԽС�������¶�ƽ�����淴Ӧ�ƶ����¶�ƽ�ⳣ�����ͣ��¶�Խ��ƽ�ⳣ��ԽС����K1��K2��
�ʴ�Ϊ������
�������ӵĶ����ƶ���֪���缫Ϊȼ�ϵ�صĸ������Ҳ�缫Ϊȼ�ϵ�ص���������������������Ӧ���״��ڸ����ŵ磬��bͨ��CH3OH��������Ӧ��ԭ��Ӧ�������������ŵ磬������ӦʽΪO2+4e-+4H+=2H2O��6.4g�״���CH3OH�������ʵ���Ϊ
| 6.4g |
| 32g/mol |
�ʴ�Ϊ��CH3OH��O2+4e-+4H+=2H2O��1.2��
���������⿼�黯ѧƽ���ж����ƶ�����ѧƽ�ⳣ����Ӱ�컯ѧ��Ӧ���ʵ����ء�ԭ��صȣ��ۺ��Խϴ��Ѷ��еȣ��Ƕ�֪ʶ���ۺ����ã���ǿ�Ի���֪ʶ�������գ�

��ϰ��ϵ�д�
�����Ŀ
12.8gͭ��������Ũ���ᷴӦ��ͭ��ȫ���ú��ռ�������5.6L����״��������Ӧ����HNO3�����ʵ��������ǣ�������
| A��0.25mol |
| B��1.0mol |
| C��0.65mol |
| D��0.5mol |
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺