题目内容
(1)向胶体中加入电解质能使胶体凝聚.使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(m mol/L),称做“聚沉值”,电解质的“聚沉值”越小,则表示其凝聚能力 (填“越小”或“越大”).实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为 .(填序号)
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土胶体微粒带负电荷)变成较洁净的水,加入等质量的量的下列电解质时,哪种效果最明显? .(填字母)为什么? .
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
(3)某同学配制好两瓶Na2SO4溶液,一瓶为饱和溶液,另一瓶为0.1mol/L的非饱和溶液,还没来得及贴上标签就搞混了.区别这两种溶液最简单的方法是 .
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土胶体微粒带负电荷)变成较洁净的水,加入等质量的量的下列电解质时,哪种效果最明显?
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
(3)某同学配制好两瓶Na2SO4溶液,一瓶为饱和溶液,另一瓶为0.1mol/L的非饱和溶液,还没来得及贴上标签就搞混了.区别这两种溶液最简单的方法是
考点:胶体的重要性质
专题:溶液和胶体专题
分析:(1)由题目信息,使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(m mol/L),称做“聚沉值”,当所需的电解质的浓度越小即聚沉值越小时时,说明其凝聚能力越大;胶体的凝聚能力主要决定于胶粒带相反电荷的离子所带的电荷数.因Fe(OH)3胶体粒子带正电荷,则加入电解质的阴离子所带电荷数越多,其聚沉能力越大,聚沉值越小.
(2)凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.黏土胶体微粒带负电荷,故凝聚效果取决于阳离子所带的电荷数.据此计算.
(3)根据一瓶为饱和溶液,另一瓶为非饱和溶液,可以分别取少量溶液于试管中,分别加入少量的Na2SO4固体,看能不能溶解.
(2)凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.黏土胶体微粒带负电荷,故凝聚效果取决于阳离子所带的电荷数.据此计算.
(3)根据一瓶为饱和溶液,另一瓶为非饱和溶液,可以分别取少量溶液于试管中,分别加入少量的Na2SO4固体,看能不能溶解.
解答:
解:(1)使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(m mol/L),称做“聚沉值”,当所需的电解质的浓度越小即聚沉值时,说明其凝聚能力越大;Fe(OH)3胶体粒子带正电荷,故加入的阴离子可以相互中和电性,减小同种电性相互排斥而使之聚沉.依据题意,阴离子所带的负电荷数越大,聚沉能力越大,“聚沉值”越小.
①NaCl中一个氯离子带一个负电荷,故①不符合;
②FeCl3中一个氯离子带一个负电荷,故②不符合;
③K2S04中一个硫酸根离子带2个负电荷,故③不符合;
④Na3P04中一个磷酸根离子带3个负电荷,故④符合;
故答案为:越大,④.
(2)凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.黏土胶体微粒带负电荷,故凝聚效果取决于阳离子所带的电荷数.
设质量为1g,
A、BaCl2 的物质的量n=
=
=
mol,含有的阳离子所带的电荷的物质的量n=
mol×1×2=
mol;
B、Al2(SO4)3物质的量n=
=
=
mol,含有的阳离子所带的电荷的物质的量n=
mol×2×3=
mol;
C、KCl物质的量n=
=
=
mol,含有的阳离子所带的电荷的物质的量n=
mol×1×1=
mol;
D、CuSO4的物质的量n=
=
=
mol,含有的阳离子所带的电荷的物质的量n=
mol×1×2=
mol;
等质量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好,故选B.
故答案为:B,等质量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好.
(3)根据一瓶为饱和溶液,另一瓶为非饱和溶液,分别取少量溶液于试管中,分别加入少量的Na2SO4固体,Na2SO4固体不溶解的为饱和溶液,Na2SO4固体溶解的为不饱和溶液.
故答案为:分别取少量溶液于试管中,分别加入少量的Na2SO4固体,Na2SO4固体不溶解的为饱和溶液,Na2SO4固体溶解的为不饱和溶液.
①NaCl中一个氯离子带一个负电荷,故①不符合;
②FeCl3中一个氯离子带一个负电荷,故②不符合;
③K2S04中一个硫酸根离子带2个负电荷,故③不符合;
④Na3P04中一个磷酸根离子带3个负电荷,故④符合;
故答案为:越大,④.
(2)凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.黏土胶体微粒带负电荷,故凝聚效果取决于阳离子所带的电荷数.
设质量为1g,
A、BaCl2 的物质的量n=
| m |
| M |
| 1g |
| 208g/mol |
| 1 |
| 208 |
| 1 |
| 208 |
| 1 |
| 104 |
B、Al2(SO4)3物质的量n=
| m |
| M |
| 1g |
| 342g/mol |
| 1 |
| 342 |
| 1 |
| 342 |
| 1 |
| 57 |
C、KCl物质的量n=
| m |
| M |
| 1g |
| 74.5g/mol |
| 1 |
| 74.5 |
| 1 |
| 74.5 |
| 1 |
| 74.5 |
D、CuSO4的物质的量n=
| m |
| M |
| 1g |
| 160g/mol |
| 1 |
| 160 |
| 1 |
| 160 |
| 1 |
| 80 |
等质量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好,故选B.
故答案为:B,等质量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好.
(3)根据一瓶为饱和溶液,另一瓶为非饱和溶液,分别取少量溶液于试管中,分别加入少量的Na2SO4固体,Na2SO4固体不溶解的为饱和溶液,Na2SO4固体溶解的为不饱和溶液.
故答案为:分别取少量溶液于试管中,分别加入少量的Na2SO4固体,Na2SO4固体不溶解的为饱和溶液,Na2SO4固体溶解的为不饱和溶液.
点评:本题考查了胶体的重要的性质以及胶体的聚沉值的计算,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组元素,属于同一周期的一组是( )
| A、H、Li、Na |
| B、Na、Mg、Ca |
| C、Al、P、S |
| D、N、O、Cl |
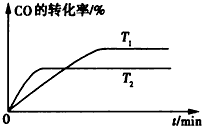
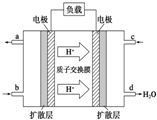
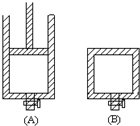 (1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=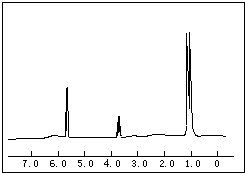 (1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇:
(1)将各有机物的序号填到对应分类中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇: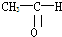 烯烃:
烯烃: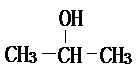 中的一种,根据图中信息,其结构简式为:
中的一种,根据图中信息,其结构简式为: