��Ŀ����
��ҵ�Ϻϳɰ����ȷ�Ӧ����ʽ���£�N2��g��+3H2��g��?2NH3��g������H=-92kJ?mol-1
��1������֪�ƻ�1molN��N����H-H���ֱ������յ�����Ϊ946kJ��436kJ����Ͽ�1molN-H�����յ�����Ϊ kJ
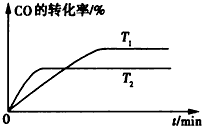
��2���ں��º�ѹ�������£���2mol N2��6molH2ͨ��һ�ݻ��ɱ�������з�Ӧ���ﵽƽ�����������Ϊ��Ӧǰ��75%����ù����ͷŵ�����Ϊ kJ��������ת����Ϊ ��ƽ�����ռ���������������Ϊ
��3������1mol N2��1molH2ͨ��������ͬ������ܱ����������У������������¶Ⱥ�������䣬�����������¶Ⱥ�ѹǿ���䣬����һ��ʱ������������ﵽƽ��״̬��
�ٽ���ƽ�������ʱ�䣺�� �ң����������������=����
�ڴﵽƽ������������������ �ң����������������=����
��1������֪�ƻ�1molN��N����H-H���ֱ������յ�����Ϊ946kJ��436kJ����Ͽ�1molN-H�����յ�����Ϊ
��2���ں��º�ѹ�������£���2mol N2��6molH2ͨ��һ�ݻ��ɱ�������з�Ӧ���ﵽƽ�����������Ϊ��Ӧǰ��75%����ù����ͷŵ�����Ϊ
��3������1mol N2��1molH2ͨ��������ͬ������ܱ����������У������������¶Ⱥ�������䣬�����������¶Ⱥ�ѹǿ���䣬����һ��ʱ������������ﵽƽ��״̬��
�ٽ���ƽ�������ʱ�䣺��
�ڴﵽƽ������������������
���㣺�йط�Ӧ�ȵļ���,��ѧƽ���Ӱ������,��ѧƽ��ļ���
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��
��������1���Ȼ�ѧ����ʽ�У���Ӧ��=��Ӧ����ܼ���-��������ܼ��ܣ��ݴ˼�����Ͽ�1mol N-H�����յ�������
��2�����ݻ�ѧƽ�������ʽ��ʽ����õ�ƽ�����ʵ�����
N2 +3H2 =2 NH3��
��ʼ����mol��2 6 0
�仯����mol��x 3x 2x
ƽ������mol��2-x 6-3x 2x
ƽ�����������Ϊ��Ӧǰ��75%����
��100%=75%�����x=1��������ʵ��������������ȡ�ת���ʡ���������ĸ�����㣻
��3�������������¶Ⱥ�ѹǿ���䣬�൱���ڼ��������ϼ�С�����������������ʿ죬����ƽ���ʱ��̣�ƽ�������ƶ���
��2�����ݻ�ѧƽ�������ʽ��ʽ����õ�ƽ�����ʵ�����
N2 +3H2 =2 NH3��
��ʼ����mol��2 6 0
�仯����mol��x 3x 2x
ƽ������mol��2-x 6-3x 2x
ƽ�����������Ϊ��Ӧǰ��75%����
| 2-x+6-3x+2x |
| 2+6 |
��3�������������¶Ⱥ�ѹǿ���䣬�൱���ڼ��������ϼ�С�����������������ʿ죬����ƽ���ʱ��̣�ƽ�������ƶ���
���
�⣺��1����֪��N��N����H-H���ļ�����Ϊ946kJ/mol��436kJ/mol����N-H�ļ���Ϊx�����ڷ�ӦN2��g��+3H2��g��=2NH3��g����H=-92kJ/mol����Ӧ��=��Ӧ����ܼ���-��������ܼ��ܣ���946kJ/mol+3��436kJ/mol-2��3��x=-92kJ/mol����ã�x=391kJ/mol��
�ʴ�Ϊ��391��
��2�����ݻ�ѧƽ�������ʽ��ʽ����õ�ƽ�����ʵ�����
N2 +3H2 =2 NH3��
��ʼ����mol��2 6 0
�仯����mol��x 3x 2x
ƽ������mol��2-x 6-3x 2x
ƽ�����������Ϊ��Ӧǰ��75%����
��100%=75%�����x=1��
��N2��g��+3H2��g��?2NH3��g������H=-92kJ?mol-1��֪���ù����ͷŵ�����Ϊ92kJ��������ת����Ϊ
��100%=50%��ƽ�����ռ���������������Ϊ
=
��
�ʴ�Ϊ��92��50%��
��
��3�������������¶Ⱥ�ѹǿ���䣬�൱���ڼ��������ϼ�С�����������������ʿ죬����ƽ���ʱ��̣�ƽ�������ƶ��������������������
�ʴ�Ϊ���٣����ڣ���
�ʴ�Ϊ��391��
��2�����ݻ�ѧƽ�������ʽ��ʽ����õ�ƽ�����ʵ�����
N2 +3H2 =2 NH3��
��ʼ����mol��2 6 0
�仯����mol��x 3x 2x
ƽ������mol��2-x 6-3x 2x
ƽ�����������Ϊ��Ӧǰ��75%����
| 2-x+6-3x+2x |
| 2+6 |
��N2��g��+3H2��g��?2NH3��g������H=-92kJ?mol-1��֪���ù����ͷŵ�����Ϊ92kJ��������ת����Ϊ
| 1mol |
| 2mol |
| 2 |
| 1+3+2 |
| 1 |
| 3 |
�ʴ�Ϊ��92��50%��
| 1 |
| 3 |
��3�������������¶Ⱥ�ѹǿ���䣬�൱���ڼ��������ϼ�С�����������������ʿ죬����ƽ���ʱ��̣�ƽ�������ƶ��������������������
�ʴ�Ϊ���٣����ڣ���
���������⿼���˻�ѧƽ����й�֪ʶ���������ջ���֪ʶ����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
��֪��
����KClO3�����еμ�Ũ���ᣬ��������ɫ���壮
����NaI��Һ��ͨ������ʵ��ٲ��������壬��Һ���ɫ��
��ȡʵ������ɵ���Һ���ڵ���KI��ֽ�ϣ���ֽ����ɫ��
�����ж���ȷ���ǣ�������
����KClO3�����еμ�Ũ���ᣬ��������ɫ���壮
����NaI��Һ��ͨ������ʵ��ٲ��������壬��Һ���ɫ��
��ȡʵ������ɵ���Һ���ڵ���KI��ֽ�ϣ���ֽ����ɫ��
�����ж���ȷ���ǣ�������
| A��ʵ���֤��Cl-���������� |
| B��ʵ������������뻹ԭ�������ʵ���֮��Ϊ2��1 |
| C��ʵ���˵��KI������ |
| D������ʵ��֤�������ԣ�ClO3-��Cl2��I2 |
�±�Ϊij�л���ֱ�������Լ���Ӧ�������������л�������ǣ�������
| �Լ� | �� | ���Ը��������Һ | NaHCO3��Һ |
| ���� | �ų����� | ��ɫ | ����Ӧ |
| A��CH2�TCH-COOH |
| B��CH2�TCHCH3 |
| C��CH3COOCH2CH3 |
| D��CH2�TCHCH2OH |

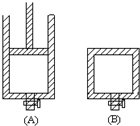 ��1����50mL 0.55mol/L NaOH��Һ��50mL 0.25mol/L H2SO4��Һ�����к��Ȳⶨ��ʵ�飬�����Һ�ڷ�Ӧǰ����¶ȱ仯Ϊt1�桫t2�棨t2��t1������Ϻ���Һ�ı�����Ϊc=4.18J/��g?�棩����Һ���ܶȶ�����Ϊ1g/mL���к��ȡ�H=
��1����50mL 0.55mol/L NaOH��Һ��50mL 0.25mol/L H2SO4��Һ�����к��Ȳⶨ��ʵ�飬�����Һ�ڷ�Ӧǰ����¶ȱ仯Ϊt1�桫t2�棨t2��t1������Ϻ���Һ�ı�����Ϊc=4.18J/��g?�棩����Һ���ܶȶ�����Ϊ1g/mL���к��ȡ�H=