题目内容
将Na2CO3和NaHCO3混合物19g,充分加热后,收集到1.12L(标准状况)CO2,冷却后将剩余固体溶于水中,配制成300ml溶液.求:
(1)原混合物中NaHCO3的质量.
(2)所配制的溶液的物质的量浓度.
(1)原混合物中NaHCO3的质量.
(2)所配制的溶液的物质的量浓度.
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)固体加热时发生2NaHCO3
Na2CO3+CO2↑+H2O,由充分反应生成的二氧化碳气体可计算原混合物中NaHCO3质量,进而计算碳酸氢钠的质量;
(2)反应后的固体中只有Na2CO3,为生成的碳酸钠与原混合物中碳酸钠之和,根据二氧化碳计算生成的碳酸钠的物质的量,根据n=
计算原混合物中碳酸钠的物质的量,根据c=
计算碳酸钠溶液的物质的量浓度.
| ||
(2)反应后的固体中只有Na2CO3,为生成的碳酸钠与原混合物中碳酸钠之和,根据二氧化碳计算生成的碳酸钠的物质的量,根据n=
| m |
| M |
| n |
| V |
解答:
解:(1)收集到CO2有1.12L,则:
2NaHCO3
Na2CO3+CO2↑+H2O,
168g 22.4L
m(NaHCO3) 1.12L
所以m(NaHCO3)=
×168g=8.4g,
故原混合物中碳酸钠的质量为19g-8.4g=10.6g,
答:原混合物中NaHCO3的质量为8.4g;
(2)令生成碳酸钠的物质的量为xmol,则:
2NaHCO3
Na2CO3+CO2↑+H2O,
1mol 22.4L
xmol 1.12L
则:x=
×1=0.05,
原混合物中Na2CO3的物质的量为:
=0.1mol,
故反应后的Na2CO3的总的物质的量为:0.1mol+0.05mol=0.15mol,
碳酸钠溶液的物质的量浓度为:c(Na2CO3)=
=0.5mol/L,
答:碳酸钠溶液的物质的量浓度为0.5mol/L.
2NaHCO3
| ||
168g 22.4L
m(NaHCO3) 1.12L
所以m(NaHCO3)=
| 1.12L |
| 22.4L |
故原混合物中碳酸钠的质量为19g-8.4g=10.6g,
答:原混合物中NaHCO3的质量为8.4g;
(2)令生成碳酸钠的物质的量为xmol,则:
2NaHCO3
| ||
1mol 22.4L
xmol 1.12L
则:x=
| 1.12L |
| 22.4L |
原混合物中Na2CO3的物质的量为:
| 10.6g |
| 106g/mol |
故反应后的Na2CO3的总的物质的量为:0.1mol+0.05mol=0.15mol,
碳酸钠溶液的物质的量浓度为:c(Na2CO3)=
| 0.15mol |
| 0.3L |
答:碳酸钠溶液的物质的量浓度为0.5mol/L.
点评:本题考查混合物的有关计算、根据方程式的计算等,题目难度中等,注意掌握物质的量浓度的概念及计算方法,能够根据化学方程式进行简单的化学计算.

练习册系列答案
相关题目
下表为某有机物分别与各种试剂反应的现象,则这种有机物可能是( )
| 试剂 | 钠 | 酸性高锰酸钾溶液 | NaHCO3溶液 |
| 现象 | 放出气体 | 褪色 | 不反应 |
| A、CH2═CH-COOH |
| B、CH2═CHCH3 |
| C、CH3COOCH2CH3 |
| D、CH2═CHCH2OH |
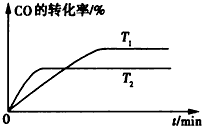
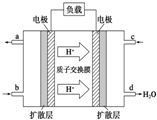

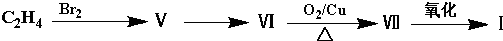
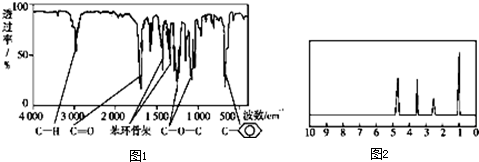
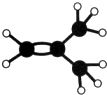 如图是某烃A分子的球棍模型.回答下列问题:
如图是某烃A分子的球棍模型.回答下列问题: (1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c=4.18J/(g?℃),溶液的密度都近似为1g/mL,中和热△H=